|
|
|
|
|
Глава 9. Молекулярно-кинетическая теория идеального газа § 60. Определение температуры. Энергия теплового движения молекул (окончание)Температура — мера средней кинетической энергии молекулИз основного уравнения молекулярно-кинетической теории (9.8) и определения температуры (9.13) вытекает важнейшее следствие:
Докажем это. Из уравнений (9.7) и (9.13) следует, что
Чем выше температура, тем быстрее движутся молекулы. Таким образом, выдвинутая ранее догадка о связи температуры со средней скоростью молекул получила надёжное обоснование. Соотношение (9.16) между температурой и средней кинетической энергией поступательного движения молекул установлено для идеальных газов. Однако оно оказывается справедливым для любых веществ, у которых движение атомов или молекул подчиняется законам механики Ньютона. Оно верно для жидкостей, а также и для твёрдых тел, где атомы могут лишь колебаться возле положений равновесия в узлах кристаллической решётки. При приближении температуры к абсолютному нулю энергия теплового движения молекул приближается к нулю, т. е. прекращается поступательное тепловое движение молекул.
Зависимость давления газа от концентрации его молекул и температуры. Учитывая, что
Из формулы (9.17) вытекает, что при одинаковых давлениях и температурах концентрация молекул у всех газов одна и та же. Отсюда следует закон Авогадро, известный вам из курса химии.
Вопросы к параграфу 1. На каком основании можно предполагать существование связи между температурой и кинетической энергией молекул? 2. Как связаны объём, давление и число молекул различных газов в состоянии теплового равновесия? 3. Чему равен абсолютный нуль температуры по шкале Цельсия? 4. Какие преимущества имеет абсолютная шкала температур по сравнению со шкалой Цельсия? 5. Каков физический смысл постоянной Больцмана? Можно ли её определить теоретически, не обращаясь к эксперименту? 6. Как зависит от температуры средняя кинетическая энергия поступательного движения молекул газа? 7. Почему концентрация молекул всех газов одна и та же при одинаковых давлениях и температурах? 8. Как зависит средняя кинетическая энергия поступательного движения молекул от их массы? Образцы заданий ЕГЭ А 1. Температура газа в сосуде равна 2 °С. По абсолютной шкале температур это составляет 1) 136,5 К 2) 271 К 3) 275 К 4) 546 К А 2. На рисунке показана часть шкалы комнатного термометра. Определите абсолютную температуру воздуха в комнате. 1) 22 °С 2) 18 °С 3) 295 К 4) 291 К
А 3. Как изменится средняя кинетическая энергия теплового движения одноатомного идеального газа при повышении его температуры в 2 раза? 1) увеличится в 4 раза 3) уменьшится в 2 раза 2) увеличится в 2 раза 4) уменьшится в 4 раза А 4. В закрытом сосуде абсолютная температура идеального газа уменьшилась в 3 раза. При этом давление газа на стенки сосуда 1) увеличилось в 9 раз 3) уменьшилось в √3 раза 2) уменьшилось в 3 раза 4) не изменилось
|
|
|



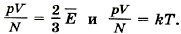 Отсюда вытекает связь между средней кинетической энергией поступательного движения молекулы и температурой:
Отсюда вытекает связь между средней кинетической энергией поступательного движения молекулы и температурой:

 Обсудите с одноклассником, можно ли считать, что средняя кинетическая энергия теплового движения молекул — мера температуры.
Обсудите с одноклассником, можно ли считать, что средняя кинетическая энергия теплового движения молекул — мера температуры.
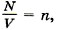 из формулы (9.13) получим выражение, показывающее зависимость давления газа от концентрации молекул и температуры:
из формулы (9.13) получим выражение, показывающее зависимость давления газа от концентрации молекул и температуры:

