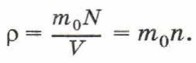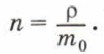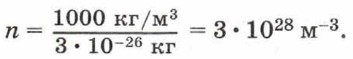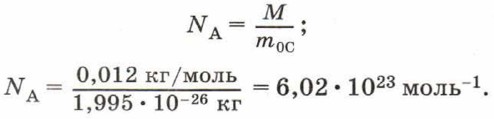|
|
|
|
|
Глава 4. Основы молекулярно-кинетической теории строения вещества § 20. Атомы и молекулы, их характеристики (окончание)Концентрация молекул7. Постоянная Авогадро. Поскольку молекулы имеют малые размеры, их число в любом макроскопическом теле очень велико. Число молекул в единице объёма называют концентрацией. Концентрация n вычисляется по формуле
где N — число молекул в теле, V — его объём. Концентрацию молекул в теле также можно определить, зная плотность вещества ρ и массу молекулы этого вещества m0. Поскольку
Отсюда
Если плотность воды ρ = 1000 кг/м3, а масса молекулы воды m0 = 3 • 10-26 кг, то концентрация молекул воды равна:
Плотность газов существенно меньше, чем плотность жидкостей, поэтому и концентрация молекул газов меньше, чем концентрация молекул жидкости. Так, если плотность водорода 9 • 10-2 кг/м3, масса молекулы водорода 3,3 • 10-27 кг, то концентрация молекул водорода равна 2,68 • 1025 м-3. Концентрация молекул любого газа при нормальных условиях (нормальном атмосферном давлении и температуре 0 °С) одинакова и равна приведённому для водорода значению. Это число называют постоянной Лошмидта: L = 2,68 • 1025 м-3. Чтобы представить себе, насколько велико это число, предположим, что в воздушном шаре сделали настолько тонкий прокол, что за каждую секунду через него проходит 10 молекул. В этом случае, для того чтобы вышли все молекулы, потребуется 30 миллиардов лет. Из определения моля следует, что 1 моль любого вещества содержит одинаковое число молекул (атомов). Это число называют постоянной Авогадро.
NА = 6,02 • 1023 моль-1. Постоянную Авогадро можно рассчитать, зная, что углероду количеством вещества 1 моль соответствует масса 0,012 кг, а масса одной молекулы углерода m0С = 1,995 • 10-26 кг. Тогда в одном моле углерода содержится число молекул:
Поскольку в одном моле любого вещества содержится одинаковое число молекул, то при одинаковых условиях 1 моль любого газа занимает одинаковый объём. Объём, занимаемый при нормальном атмосферном давлении любым газом количеством вещества 1 моль, равен 0,0224 м3. Вопросы для самопроверки 1. Сформулируйте первое положение молекулярно-кинетической теории строения вещества. 2. Поясните выражение: «Молекула — мельчайшая частица вещества, сохраняющая его химические свойства». 3. Опишите опыт, позволяющий оценить размеры молекулы. Предложите способ измерения объёма капли масла. 4. Что называют относительной молекулярной массой; количеством вещества; молярной массой; концентрацией молекул; постоянной Авогадро? 5. Что такое один моль? 6. Каков порядок значений размеров, массы молекул, их концентрации, числа молекул в одном моле вещества? Упражнение 13 1Д. Подготовьте краткое сообщение об исследованиях М. В. Ломоносова, результаты которых внесли вклад в развитие учения о строении вещества. Воспользуйтесь для этого интернет-ресурсами и другими источниками информации. Докажите, что результаты исследований М. В. Ломоносова имели принципиальное значение для развития взглядов на строение вещества. 2. Сравните количество вещества, содержащееся в телах равной массы из алюминия и железа. 3. Найдите число атомов в алюминиевой ложке массой 30 г. 4. Деталь площадью 30 см2 покрыли слоем серебра толщиной 2 мкм. Сколько атомов серебра содержится в покрытии? 5. Сравните массы и объёмы двух тел, сделанных из свинца и меди, если в них содержатся равные количества вещества. 6. Вычислите постоянную Авогадро, если известно, что масса молекулы кислорода 5,312 • 10-26 кг. Ответы 2. νAl/νFe ≈ 2. 3. 0,7 • 1024. 4. 3,5 • 1020. 5. mРb ≈ 3mСu; VPb ≈ 2,4VCu. 6. 6,022 • 1023 моль-1. Вопросы для дискуссии Почему мы уверены в существовании молекул и атомов, ведь мы их не видим?
|
|
|



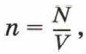
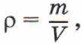 где m — масса тела, и m = m0N, то
где m — масса тела, и m = m0N, то