|
|
|
|
|
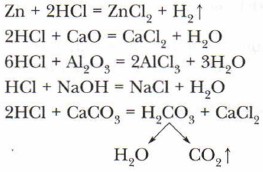
Глава 12. Галогены § 55. Хлороводород, соляная кислота и их свойств (окончание)Хлороводородная (соляная) кислота и её солиФизические свойства. Концентрированная соляная кислота — бесцветный раствор, дымит во влажном воздухе, с резким запахом хлороводорода. Можно получить 40 %-й раствор соляной кислоты. Химические свойства. Хлороводородная кислота имеет ряд свойств, характерных для большинства кислот. К таким свойствам относятся: 1) изменение окраски индикаторов (лакмуса, метилоранжа) на красный; 2) взаимодействие с металлами, стоящими в ряду активности до водорода, с осно́вными и амфотерными оксидами, с основаниями, с солями слабых кислот:
В этих реакциях получаются соли соляной кислоты — хлориды и другие продукты. Особенное свойство соляной кислоты — реакция с раствором нитрата серебра. Используя эту реакцию, соляную кислоту можно отличить от других кислот. Проделаем лабораторные опыты.
НСl + AgNO3 = AgCl ↓ + HNO3 Белый творожистый осадок (AgCl) не растворяется в азотной кислоте. Соли соляной кислоты называются хлоридами. Они все растворимы в воде, за исключением хлорида серебра и хлорида свинца (II). Если добавить к раствору хлорида раствор нитрата серебра, то выпадет такой же творожистый белый осадок: NaCl + AgNO3 = AgCl ↓ + NaNO3 Нитрат серебра (или азотнокислое серебро) служит реактивом на соляную кислоту и её соли. Эта реакция называется качественной реакцией. С помощью этой качественной реакции распознают соляную кислоту и её соли.
Применение соляной кислоты. Соляную кислоту используют в разных областях народного хозяйства. В большом количестве её расходуют при травлении стали, перед покрытием стальных изделий слоем защитного металла (лужение, никелирование, хромирование). Перед этими процессами необходимо удалить плёнку оксидов с поверхности изделия. Недостаток этой операции заключается в том, что кислота реагирует не только с оксидом железа, но и с самим металлом. Чтобы избежать реакции кислоты с металлом, в кислоту добавляют специальные вещества, замедляющие нежелательную реакцию, — ингибиторы. Соляную кислоту используют в производстве лекарств, красителей, ядохимикатов, пластмасс и других полимеров, а также для получения в лаборатории хлора и некоторых хлоридов. Раствор соляной кислоты (0,5 %) назначают больным с пониженной кислотностью желудочного сока. Основные понятия Свойства хлороводорода • Качественная реакция на соляную кислоту и её соли • Ингибитор Вопросы и задания
|
|
|



 1. К небольшому объёму соляной кислоты в пробирке прилейте немного раствора нитрата серебра. Что наблюдаете?
1. К небольшому объёму соляной кислоты в пробирке прилейте немного раствора нитрата серебра. Что наблюдаете?
 1. Почему при получении соляной кислоты в лаборатории важно, чтобы конец газоотводной трубки не касался поверхности воды?
1. Почему при получении соляной кислоты в лаборатории важно, чтобы конец газоотводной трубки не касался поверхности воды?
 2. Почему для получения хлороводорода в лаборатории используют кристаллический хлорид натрия (поваренную соль) и концентрированную серную кислоту?
2. Почему для получения хлороводорода в лаборатории используют кристаллический хлорид натрия (поваренную соль) и концентрированную серную кислоту?
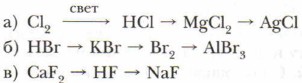
 7. С какими из перечисленных веществ будет реагировать соляная кислота: Zn, Cu(OH)2, Аl2O3, Н2O, NaOH, Ag? Напишите уравнения осуществимых реакций.
7. С какими из перечисленных веществ будет реагировать соляная кислота: Zn, Cu(OH)2, Аl2O3, Н2O, NaOH, Ag? Напишите уравнения осуществимых реакций.