|
|
|
|
|
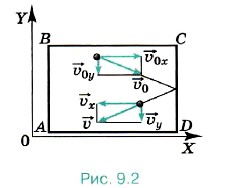
Глава 9. Молекулярно-кинетическая теория идеального газа § 57. Основное уравнение молекулярно-кинетической теории газов (окончание)Основное уравнение молекулярно-кинетической теории (МКТ) газов. Строгий вывод уравнения молекулярно-кинетической теории газов довольно сложен. Поэтому мы ограничимся упрощённым выводом уравнения. Предположим, что газ идеальный и взаимодействие молекул со стенкой абсолютно упругое. Вычислим давление газа, находящегося в сосуде, на боковую стенку площадью S, перпендикулярную координатной оси ОХ (рис. 9.2).
При ударе молекулы о стенку её импульс изменяется: Δрх = m0(υх - υ0x). При абсолютно упругом взаимодействии модули скорости молекулы до и после удара равны, и тогда изменение импульса Δрх = 2m0υx. Согласно второму закону Ньютона изменение импульса молекулы равно импульсу подействовавшей на неё силы со стороны стенки сосуда, а согласно третьему закону Ньютона импульс силы, с которой молекула подействовала на стенку, будет иметь то же значение. Следовательно, в результате удара молекулы на стенку подействовала сила, импульс которой равен 2m0|υx|. Молекул много, и каждая из них передаёт стенке при столкновении такой же импульс. За время t они передадут стенке импульс 2m0|υx|Z, где Z — число ударов всех молекул о стенку за это время. Число Z, очевидно, прямо пропорционально концентрации молекул, т. е. числу молекул в единице объёма, а также скорости молекул |υx|. Чем больше эта скорость, тем больше молекул за время t успеют столкнуться со стенкой. Если бы молекулы «стояли на месте», то столкновений их со стенкой не было бы совсем. Кроме того, число столкновений молекул со стенкой пропорционально площади S поверхности стенки: Z ~ n|υx|St. Надо ещё учесть, что в среднем только половина всех молекул движется к стенке. Благодаря хаотичному движению направления движения молекул по и против оси ОХ равновероятны, поэтому вторая половина молекул движется в обратную сторону. Значит, число ударов молекул о стенку за время t Учтём, что не все молекулы имеют одно и то же значение квадрата скорости υ2x. В действительности средняя сила, действующая на стенку, пропорциональна не υ2x, а среднему значению квадрата скорости
Формула (9.6) связывает макроскопическую величину — давление, которое может быть измерено манометром, — с микроскопическими параметрами, характеризующими молекулы: их массой, концентрацией, скоростью хаотичного движения. Связь давления со средней кинетической энергией молекул. Если через
Вопросы к параграфу 1. Чем пренебрегают, когда реальный газ рассматривают как идеальный? 2. Газ оказывает давление на стенки сосуда. А давит ли один слой газа на другой? 3. Всегда ли равноправны средние значения проекций скорости движения молекул? 4. Чему равно среднее значение проекции скорости молекул на ось ОХ? 5. Почему молекула при соударении со стенкой действует на неё с силой, пропорциональной скорости, а давление пропорционально квадрату скорости молекулы? 6. Почему и как в основном уравнении молекулярно-кинетической теории появляется множитель 7. Как средняя кинетическая энергия молекул связана с концентрацией газа и его давлением на стенки сосуда?
<<< К началу параграфа Следующая страница >>>
|
|
|



 Уравнение молекулярно-кинетической теории — первое количественное соотношение, полученное в МКТ, поэтому оно называется основным. После вывода этого уравнения в XIX в. и экспериментального доказательства его справедливости началось быстрое развитие количественной теории, продолжающееся по сегодняшний день.
Уравнение молекулярно-кинетической теории — первое количественное соотношение, полученное в МКТ, поэтому оно называется основным. После вывода этого уравнения в XIX в. и экспериментального доказательства его справедливости началось быстрое развитие количественной теории, продолжающееся по сегодняшний день.
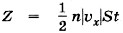 и полный импульс силы, подействовавшей на стенку, Ft = 2m0|υx|Zt. Отсюда F = nm0υ2xS.
и полный импульс силы, подействовавшей на стенку, Ft = 2m0|υx|Zt. Отсюда F = nm0υ2xS.
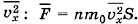 Так как согласно формуле (9.5)
Так как согласно формуле (9.5) 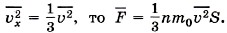 Таким образом, давление газа на стенку сосуда равно:
Таким образом, давление газа на стенку сосуда равно:

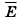 обозначить среднюю кинетическую энергию поступательного движения молекулы
обозначить среднюю кинетическую энергию поступательного движения молекулы 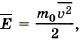 то уравнение (9.6) можно записать в виде
то уравнение (9.6) можно записать в виде

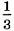 ?
?