|
|
|
|
|
Глава 2. Постоянный электрический ток Гальванические элементыТаким образом, ЭДС элемента равна сумме скачков потенциала на границах электрод — раствор электролита. Она не зависит от площади электродов и определяется лишь материалом электродов и концентрацией ионов в растворах электролитов. При перемещении единичного положительного заряда внутри элемента от цинкового электрода к медному сторонние силы, действующие на границах электрод — раствор, совершают положительную работу. Эта работа численно равна сумме скачков потенциалов |U1| + |U2|, так как химические силы, действующие в прилегающем к электроду слое раствора электролита, равны по модулю электрическим. Когда элемент разомкнут, металлы (электроды) не растворяются и не наращиваются; концентрация ионов в растворах не изменяется. Что же произойдет, если соединить медный и цинковый электроды металлической проволокой? Так как между электродами существует разность потенциалов, то по внешней цепи электроны начнут перемещаться от электрода с более низким потенциалом (цинкового) к электроду с более высоким потенциалом (медному). При этом равновесие между каждым электродом и окружающим его раствором электролита нарушается. Цинк становится недостаточно отрицательным (часть электронов с него ушла), а медь становится слишком отрицательной (сюда пришли лишние электроны). Вследствие этого цинк начнет растворяться: в раствор будут переходить дополнительные ионы Zn2+, а на цинковом электроде будут оставаться электроны, восстанавливающие его заряд. На медном электроде ионы Си2+ будут нейтрализоваться избыточными электронами и осаждаться на нем в виде нейтральных атомов. Таким образом, в результате растворения цинка и осаждения меди разность потенциалов между этими электродами будет все время сохранять постоянное значение, и в цепи будет идти длительный постоянный ток. Мы видим, что при описанном процессе внутри пористого стакана должны были бы накапливаться избыточные ионы Zn2+, а в стеклянном стакане — избыточные ионы Таким образом, в то время как во внешней цепи гальванического элемента (в проволоке) движутся электроны от места с более низким потенциалом (от отрицательного полюса элемента) к месту с более высоким потенциалом (к положительному полюсу элемента), т. е. от цинкового электрода к медному, в растворе электролита движутся ионы: отрицательные ( Так же в основном происходит процесс возникновения ЭДС и тока в других гальванических элементах, хотя часто этот основной процесс осложняется вторичными реакциями, происходящими на электродах. Поляризация гальванических элементовГальванический элемент Вольта состоял из медного и цинкового электродов, как и элемент Даниэля, но оба электрода были погружены в раствор одного электролита — раствор серной кислоты. Элемент Вольта только небольшое время после замыкания цепи дает постоянный ток. Затем сила тока быстро уменьшается. Дело здесь в следующем. В водном растворе H2SO4 присутствуют положительные ионы водорода. При работе элемента они осаждаются на медном электроде. В результате через некоторое время после замыкания цепи этот электрод покрывается тонким слоем водорода. Вместо медного электрода получается «водородный» электрод. Этот процесс носит название поляризации элемента. Скачок потенциала на границе водород — раствор электролита меньше, чем на границе медь — раствор. Поэтому ЭДС уменьшается. Говоря другими словами, поляризация элемента приводит к появлению дополнительной поляризационной ЭДС, имеющей знак, противоположный знаку ЭДС элемента. Одновременно выделение водорода сильно увеличивает внутреннее сопротивление элемента, ибо пленка водорода на медном электроде имеет большое сопротивление. Для стабильной работы элемента нужно воспрепятствовать накоплению водорода на положительном электроде элемента. Необходима, как говорят, деполяризация положительного электрода. В элементе Даниэля этого достигают применением двух растворов электролитов, подобранных так, что при работе элемента химический состав электродов не меняется. Медный электрод находится в растворе медного купороса, и при замкнутой цепи на положительном электроде осаждается не водород, а медь.
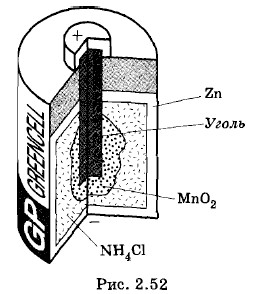
Наиболее распространенным является химический способ деполяризации, состоящий в окислении водорода и превращении его в воду. Именно на этом принципе основана деполяризация в наиболее употребительном в настоящее время элементе — элементе Лекланше. Отрицательным электродом элемента Лекланше также служит цинк. Положительный электрод состоит из угольного стерженька, окруженного смесью сильного окислителя — пероксида марганца МnO2 и графита для увеличения электропроводности (рис. 2.52). Эти электроды погружаются в раствор нашатыря (хлорида аммония — NH4Cl). В «сухих» элементах вместо жидкого раствора электролита используют густую крахмалистую массу, пропитанную нашатырем. Газообразный водород не образуется, так как происходит реакция МnО2 + 2Н = МnО + Н2О, в результате которой получается оксид марганца и вода. ЭДС элемента Лекланше около 1,4 В. Применение гальванических элементовНесмотря на то что гальванические элементы были первыми источниками тока и имеют уже почти двухвековую историю, они и сегодня находят ряд важных применений. «Сухие» гальванические элементы широко используются в радиотехнике для питания приемников, портативных магнитофонов. Разнообразные сухие элементы применяются в электронных часах, в некоторых электроизмерительных приборах, в слуховых аппаратах для людей, потерявших слух, в детских игрушках, карманных фонарях и т. д.
|
|
|



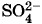 . Но эти противоположно заряженные частицы притягивают друг друга, и ионы
. Но эти противоположно заряженные частицы притягивают друг друга, и ионы