|
|
|
|
|
Глава 3. Электрический ток в различных средах Электрический ток в растворах и расплавах электролитовИонная проводимость растворов и расплавов электролитовПри отсутствии внешнего электрического поля ионы вместе с нераспавшимися молекулами находятся в хаотическом тепловом движении.
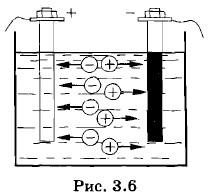
Если сосуд с раствором электролита включить в электрическую цепь, то между электродами образуется электрическое поле и ионы в растворе придут в упорядоченное движение (рис. 3.6). Положительно заряженные ионы станут двигаться по направлению напряженности поля, т. е. к катоду (электроду, соединенному с отрицательным полюсом источника тока), а отрицательно заряженные ионы — в противоположном направлении, т. e. к аноду (электроду, соединенному с положительным полюсом источника тока). Отрицательные ионы, пришедшие к аноду и называемые поэтому анионами, отдают свои лишние электроны аноду, а посредством его и соединительных проводников — положительному полюсу источника, возмещая на нем недостаток электронов. Положительные ионы, пришедшие к катоду и потому называемые катионами, получают недостающие им электроны из избытка их на катоде. Так устанавливается во внешней цепи перемещение электронов от отрицательного полюса источника тока к положительному. При этом через раствор электролита заряд переносится вместе с частицами вещества — ионами. Такую проводимость называют ионной. В расплавах электролитов проводимость также ионная, так как при плавлении твердых электролитов их молекулы распадаются на положительные и отрицательные ионы. Жидкие же металлы обладают электронной проводимостью. ЭлектролизПри прохождении электрического тока через т раствор электролита анионы отдают свои лишние электроны на аноде (в химии это называется окислительной реакцией), а катионы на катоде получают недостающие электроны (восстановительная реакция). Таким образом, на электродах при прохождении через раствор электрического тока происходит выделение веществ, входящих в состав электролитов. Процесс выделения на электродах вещества, связанный с окислительно-восстановительными реакциями, называют электролизом. В ряде случаев нейтрализуемые на электродах ионы вступают в химические реакции с растворителем, растворенными веществами или с веществом электродов. Эти реакции называют вторичными. Так, например, при электролизе раствора медного купороса (CuSO4) на катоде выделяется медь, а на аноде — кислотный остаток SO4, который вступает в реакцию с веществом анода — медью: Си + SO4 = CuSO4. Благодаря этой реакции концентрация раствора медного купороса остается неизменной. Происходит лишь перенос меди с анода на катод, пока анод полностью не израсходуется. В случае платинового анода при электролизе раствора медного купороса происходит реакция с растворителем: 2SO4 + 2Н2O — 2H2SO4 + O2. Молекулы серной кислоты попадают в раствор, а молекулярный кислород выделяется в виде пузырьков. Закон ОмаДля растворов электролитов справедлив закон Ома. Это утверждение можно обосновать подобно тому, как это было сделано в предыдущем параграфе для металлических проводников.
При постоянной температуре графиком, выражающим зависимость силы тока от напряжения (вольт-амперная характеристика) для растворов электролитов, является, как и для металлического проводника, прямая линия. Однако эта прямая не проходит через начало координат, а «сдвинута» вправо (рис. 3.7). Это объясняется тем, что при электролизе происходит поляризация электродов, погруженных в раствор электролита (см. § 2.12), причем ЭДС поляризации
|
|
|



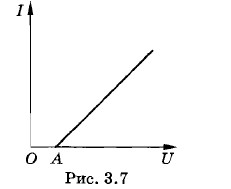
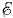 р имеет знак, противоположный знаку напряжения U на электродах. На рисунке 3.7 отрезок О А соответствует ЭДС поляризации.
р имеет знак, противоположный знаку напряжения U на электродах. На рисунке 3.7 отрезок О А соответствует ЭДС поляризации.