|
|
|
|
|
§ 42. Первый закон термодинамики Внутренняя энергия газаИз курса физики основной школы вы знаете, что сумму кинетической энергии хаотического движения частиц и потенциальной энергии их взаимодействия называют внутренней энергией. Внутренняя энергия U данной массы одноатомного идеального газа равна произведению средней кинетической энергии
где ν — количество вещества в газе. Подсказка. Воспользуйтесь тем, что Итак, внутренняя энергия идеального газа определяется только его абсолютной температурой и числом молекул в нём.
а) Чему равна внутренняя энергия этого газа, если он одноатомный и его можно считать идеальным? б) На какую высоту можно было бы забросить мяч массой 365 г, если бы можно было сообщить ему такую кинетическую энергию и пренебречь сопротивлением воздуха? Выполнив это задание, вы сможете представить, как велика внутренняя энергия тела. Объясняется это тем, что скорость хаотического движения молекул в десятки и сотни раз превышает скорости движения окружающих нас тел. А кинетическая энергия пропорциональна квадрату скорости. Поэтому при увеличении скорости в 10 раз кинетическая энергия увеличивается в 100 раз, а при увеличении скорости в 100 раз кинетическая энергия увеличивается в 10 000 раз. Внутреннюю энергию идеального одноатомного газа можно выразить также через его давление р и объём V.
Подсказка. Воспользуйтесь формулой (1) и уравнением состояния идеального газа.
|
|
|



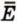 одной молекулы на число молекул N:
одной молекулы на число молекул N:
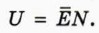
 1. Объясните, почему внутренняя энергия U данной массы одноатомного идеального газа выражается формулой
1. Объясните, почему внутренняя энергия U данной массы одноатомного идеального газа выражается формулой

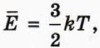 N = νNA, R = kNA.
N = νNA, R = kNA.
