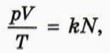|
|
|
|
|
§ 40. Уравнение состояния идеального газа Закон АвогадроИз уравнения Клапейрона (см. предыдущий параграф) следует, что в процессах, происходящих с данной массой газа, произведение давления газа р на его объём V, делённое на аболютную температуру Т газа, постоянно: Однако если масса газа в процессе изменилась, то значение выражения
От чего же зависит значение отношения Оказывается, что это не так: опыт показывает, что если для различных газов сделать одинаковым значение отношения 1 Из дальнейшего вы догадаетесь, почему масса водорода взята равной 2 г.
Ответ на вопрос, от чего зависит значение выражения Исследуя химические реакции между газами, он открыл закон, который называют сегодня законом Авогадро: в равных объёмах различных газов при одинаковых температурах и давлениях содержится одинаковое число молекул. Отсюда следует, что значение выражения
где k — коэффициент пропорциональности, одинаковый для всех газов. Его назвали постоянной Больцмана в честь австрийского физика Людвига Больцмана. Измерения показали, что k = 1,38 • 10-23 Дж/К. Из закона Алогадро следует, что главной характеристикой газа является число молекул.
|
|
|



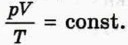
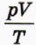 тоже изменится! Это очень легко проверить.
тоже изменится! Это очень легко проверить.