|
|
|
|
|
Глава 16. Электрический ток в различных средах Электрический ток в жидкостях. Закон электролизаЗакон ФарадеяОбозначим через k коэффициент пропорциональности между массой m вещества и зарядом Δq = IΔt, прошедшим через электролит:
где F = eNA = 9,65 • 104 Кл/моль — постоянная Фарадея. Коэффициент k зависит от природы вещества (значений М и n). Согласно формуле (16.6) имеем m = kIΔt. (16.8)
Это утверждение, полученное нами теоретически, впервые было установлено экспериментально Фарадеем.
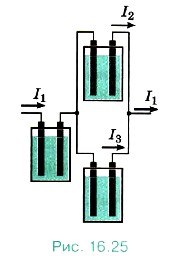
Электрохимический эквивалент имеет простой физический смысл. Так как M/NA = m0i и еn = q0i, то согласно формуле (16.7) k = rn0i/q0i, т. е. k — отношение массы иона к его заряду. Измеряя величины m и Δq, можно определить электрохимические эквиваленты различных веществ. Убедиться в справедливости закона Фарадея можно на опыте. Соберём установку, показанную на рисунке (16.25). Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов через I1, I2, I3. Тогда I1 = I2 + I3. Измеряя массы m1, m2, m3 веществ, выделившихся на электродах в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам токов I1, I2, I3.
Определение заряда электрона. Формулу (16.6) для массы выделившегося на электроде вещества можно использовать для определения заряда электрона. Из этой формулы вытекает, что модуль заряда электрона равен:
Зная массу m выделившегося вещества при прохождении заряда IΔt, молярную массу М, валентность п атомов и постоянную Авогадро NA, можно найти значение модуля заряда электрона. Оно оказывается равным e = 1,6 • 10-19 Кл. Именно таким путём и было впервые в 1874 г. получено значение элементарного электрического заряда.
|
|
|




 Предложите свою схему опыта, с помощью которого можно было бы проверить справедливость закона Фарадея. Проведите опыт.
Предложите свою схему опыта, с помощью которого можно было бы проверить справедливость закона Фарадея. Проведите опыт.
