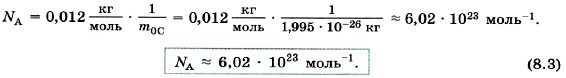|
|
|
|
|
Глава 8. Основы молекулярно-кинетической теории Основные положения молекулярно-кинетической теории. Размеры молекулМасса молекулМассы отдельных молекул и атомов очень малы. Мы вычислили, что в 1 г воды содержится 3,7 • 1022 молекул. Следовательно, масса одной молекулы воды (Н20) равна:
Массу такого же порядка имеют молекулы других веществ, исключая огромные молекулы органических веществ; например, белки имеют массу, в сотни тысяч раз большую, чем масса отдельных атомов. Но всё равно их массы в макроскопических масштабах (граммах и килограммах) чрезвычайно малы. Относительная молекулярная масса Так как массы молекул очень малы, удобно использовать в расчётах не абсолютные значения масс, а относительные.
Относительные атомные массы всех химических элементов точ- но измерены. Складывая относительные атомные массы элементов, входящих в состав молекулы вещества, можно вычислить относительную молекулярную массу вещества. Например, относительная молекулярная масса углекислого газа СO2 приближённо равна 44, так как относительная атомная масса углерода практически равна 12, а кислорода примерно 16 : 12 + 2 • 16 = 44.
Количество вещества и постоянная АвогадроКоличество вещества наиболее естественно было бы измерять числом молекул или атомов в теле. Но число молекул в любом макроскопическом теле так велико, что в расчётах используют не абсолютное число молекул, а относительное их число. В Международной системе единиц количество вещества выражают в молях.
Значит, в одном моле любого вещества содержится одно и то же число атомов или молекул.
Для определения постоянной Авогадро надо найти массу одного атома углерода. Приближённая оценка массы может быть произведена так, как это было сделано выше для массы молекулы воды (наиболее точные методы основаны на отклонении пучков ионов электромагнитным полем). Для массы атома углерода измерения дают: mос = 1,995 • 10-26 кг. Постоянную Авогадро NA можно определить, разделив массу углерода, взятого в количестве одного моля, на массу одного атома углерода:
|
|
|



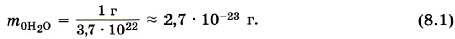
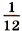 массы атома углерода (так называемая углеродная шкала атомных масс).
массы атома углерода (так называемая углеродная шкала атомных масс).

 Сравнение атомов и молекул с
Сравнение атомов и молекул с  Откройте в электронном приложении таблицу Менделеева и посчитайте относительную молекулярную массу некоторых известных вам молекул.
Откройте в электронном приложении таблицу Менделеева и посчитайте относительную молекулярную массу некоторых известных вам молекул.