|
|
|
|
|
Глава 9. Молекулярно-кинетическая теория идеального газа Определение температуры. Энергия теплового движения молекулОпределение температурыМожно, следовательно, утверждать, что величина Θ растёт с повышением температуры. Более того, Θ ни от чего, кроме температуры, не зависит. Ведь для идеальных газов Θ не зависит ни от рода газа, ни от его объёма или давления, а также от числа частиц в сосуде. Этот опытный факт позволяет рассматривать величину Θ как естественную меру температуры, как параметр газа, определяемый через другие макроскопические параметры газа. В принципе можно было бы считать температурой и саму величину Θ и измерять температуру в энергетических единицах — джоулях. Однако, во-первых, это неудобно для практического использования (температуре 100 °С соответствовало бы очень малое значение — порядка 10-21 Дж), а во-вторых, и это главное, уже давно
Абсолютная температура. Вместо температуры Θ, выражаемой в энергетических единицах, введём температуру, выражаемую в привычных для нас градусах. Будем считать величину Θ прямо пропорциональной температуре Т, измеряемой в градусах: Θ = kТ, (9.12) где k — коэффициент пропорциональности.
Такое название, как мы сейчас увидим, имеет достаточные основания. Учитывая определение (9.12), получим
По этой формуле вводится температурная шкала (в градусах), не зависящая от вещества, используемого для измерения температуры. Температура, определяемая формулой (9.13), очевидно, не может быть отрицательной, так как все величины, стоящие в левой части этой формулы, заведомо положительны. Следовательно, наименьшим возможным значением температуры Т является значение Т = 0, если давление р или объём V равны нулю.
Это самая низкая температура в природе, та «наибольшая или последняя степень холода», существование которой предсказывал Ломоносов. Английский учёный У. Томсон (лорд Кельвин) (1824—1907) ввёл абсолютную шкалу температур. Нулевая температура по абсолютной шкале (её называют также шкалой Кельвина) соответствует абсолютному нулю, а каждая единица температуры по этой шкале равна градусу по шкале Цельсия.
Постоянная БольцманаОпределим коэффициент k в формуле (9.13) так, чтобы изменение температуры на один кельвин (1 К) было равно изменению температуры на один градус по шкале Цельсия (1 °С). Мы знаем значения величины Θ при 0 °С и 100 °С (см. формулы (9.9) и (9.11)). Обозначим абсолютную температуру при 0 °С через Т1, а при 100 °С через Т2. Тогда согласно формуле (9.12) Θ100 - Θ0 = k(T2 -T1), Θ100 - Θ0 = k • 100 K = (5,14 - 3,76) • 10-21 Дж. Отсюда
Это одна из наиболее важных постоянных в молекулярно-кинетической теории. Зная постоянную Больцмана, можно найти значение абсолютного нуля по шкале Цельсия. Для этого найдём сначала значение абсолютной температуры, соответствующее 0 °С. Так как при 0 °С kT1 = 3,76 • 10-21 Дж, то
Один кельвин и один градус шкалы Цельсия совпадают. Поэтому любое значение абсолютной температуры Т будет на 273 градуса выше соответствующей температуры t по Цельсию: Т (К) = (t + 273) (°С). (9.15)
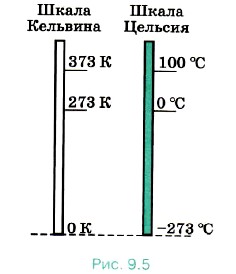
На рисунке 9.5 для сравнения изображены абсолютная шкала и шкала Цельсия. Абсолютному нулю соответствует температура t = -273 °С.
|
|
|




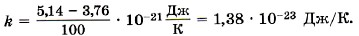

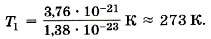
 Следует ли из фразы «Один кельвин и один градус шкалы Цельсия совпадают», что 27 °С = 27 К?
Следует ли из фразы «Один кельвин и один градус шкалы Цельсия совпадают», что 27 °С = 27 К?
 В США используется шкала Фаренгейта. Точка замерзания воды по этой шкале 32 °F, а точка кипения 212 °Е Пересчёт температуры из шкалы Фаренгейта в шкалу Цельсия производится по формуле t(°C) = 5/9 (t(°F) - 32).
В США используется шкала Фаренгейта. Точка замерзания воды по этой шкале 32 °F, а точка кипения 212 °Е Пересчёт температуры из шкалы Фаренгейта в шкалу Цельсия производится по формуле t(°C) = 5/9 (t(°F) - 32).