|
|
|
|
Главная >> Молекулярная физика. Термодинамика. Физика 10 класс. Мякишев |
|
|
Глава 3. Температура. Газовые законы § 3.1. Состояние макроскопических тел в термодинамикеВ этой главе вы узнаете немало нового о физической величине, которую каждый день упоминают в сводках погоды: о температуре, о том, как она строго научно определяется в физике.
В механике состояние системы частиц определяется их положениями (координатами) и скоростями. По начальным координатам и скоростям можно при заданных силах найти положение и скорости частиц в любой последующий момент времени. Определить подобным образом внутреннее состояние макроскопических тел, состоящих из огромного числа частиц, нельзя. Однако поведение макроскопических тел можно охарактеризовать немногим числом физических величин, относящихся не к отдельным молекулам, слагающим тела, а ко всему макроскопическому телу в целом. К числу таких величин относятся объем V, давление р, температура t и др. Так, газ данной массы всегда занимает некоторый объем, имеет определенные давление и температуру. Объем и давление представляют собой механические величины, описывающие состояние газа. Понятие температуры в механике не рассматривается, так как она характеризует внутреннее состояние тел. Макроскопические параметрыЛюбое макроскопическое тело или группа макроскопических тел называется термодинамической системой (от греч. systema — целое, составленное из частей). Величины, характеризующие состояние термодинамической системы без учета молекулярного строения тел, называют макроскопическими (или термодинамическими) параметрами. Макроскопические параметры не исчерпываются объемом, давлением и температурой. Например, для смеси газов нужно знать концентрации отдельных компонентов смеси. Если вещество находится в электрическом или магнитном поле, то необходимо задать характеристики этих полей в веществе. В то же время форма сосуда, в котором находится газ, не является существенной для определения его состояния. Например, кислород в сосуде, изображенном на рисунке 3.1, а, будет находиться точно в таком же состоянии, в каком и кислород в сосуде другой формы (рис. 3.1, б), если объемы сосудов, массы и температуры газов одинаковы. В частности, давления газов в обоих сосудах равны. Не зависит от формы сосуда сжимаемость газа и его другие свойства.
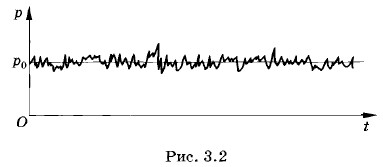
Давление газа в молекулярно-кинетической теорииНа примере давления газа выясним, какой смысл имеют макроскопические параметры с молекулярно-кинетической точки зрения. Пусть газ находится в закрытом сосуде. Манометр показывает давление газа р0. Как возникает это давление? Каждая молекула газа, ударяясь о стенку, в течение малого промежутка времени действует на нее с определенной силой. В результате беспорядочных ударов о стенку сила, действующая со стороны всех молекул на поверхность стенки единичной площади, т. е. давление, будет быстро меняться со временем примерно так, как показано на рисунке 3.2. Однако действия, вызванные ударами отдельных молекул, настолько слабы, что манометром они не регистрируются. Манометр фиксирует среднюю по времени силу, действующую на каждую единицу площади поверхности его чувствительного элемента — мембраны. Несмотря на небольшие изменения давления, среднее значение давления р0 практически оказывается вполне определенным, так как ударов о стенку очень много, а массы молекул очень малы.
|
|
|