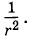|
|
|
|
Главная >> Молекулярная физика. Термодинамика. Физика 10 класс. Мякишев |
|
|
Глава 2. Основы молекулярно-кинетической теории § 2.4. Силы взаимодействия молекул
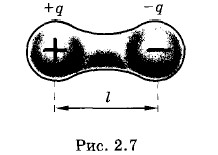
Молекулярные силыДоказать существование значительных сил взаимодействия между атомами или молекулами несложно. Попробуйте-ка сломать толстую палку! А ведь она состоит из молекул. Существование сил притяжения между атомами может доказать такой наглядный опыт. Надо взять два свинцовых бруска и острым ножом срезать тонкие слои с их торцов. При достаточном навыке срезы получаются гладкими и чистыми, свободными от оксидов свинца. Если плотно прижать бруски друг к другу свежими срезами, то они слипнутся. После этого можно один из брусков нагрузить гирей в несколько килограммов, но разрыва брусков не произойдет. Силы притяжения между атомами оказываются достаточными, чтобы предотвратить разрыв. Если бы между молекулами не существовало сил притяжения, то вещество при любых условиях находилось бы в газообразном состоянии. Только благодаря силам притяжения молекулы могут удерживаться около друг друга и образовывать жидкие и твердые тела. Но кроме сил притяжения между молекулами должны действовать силы отталкивания. В том, что между атомами или молекулами при непосредственном их сближении появляются силы отталкивания, убедиться очень просто. Если бы таких сил не существовало, то вы свободно могли бы проткнуть пальцем толстую стальную плиту. Более того, без появления сил отталкивания на очень малых расстояниях между молекулами вещество не могло бы существовать. Молекулы проникли бы друг в друга, и весь кусок вещества сжался бы до объема одной молекулы. Представления о существенной роли межмолекулярных сил для описания свойств газов впервые ввел нидерландский физик Я. Д. Ван-дер-Ваальс (1837—1923). Он не пытался установить точную зависимость сил от расстояния. Ван-дер-Ваальс считал, что на малых расстояниях между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения, сравнительно медленно убывающими при дальнейшем увеличении расстояния. Силы межмолекулярного взаимодействия часто называют ван- дер-ваальсовыми силами. Электромагнитная природа молекулярных силПриступить к теоретическому исследованию молекулярных сил до начала XX в. было почти невозможно. Простые и хорошо изученные гравитационные силы при взаимодействии столь малых тел, как молекулы, явно не могли играть заметной роли. Оставалось предположить, что молекулярные силы имеют электромагнитную природу. Любой атом и тем более молекула — это сложная система, состоящая из большого числа заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, между ними действуют значительные электрические силы: происходит взаимодействие между электронами и ядрами соседних молекул. Описание движения частиц внутри атомов и молекул — очень сложная задача. Ее рассматривают в атомной физике и решают с помощью законов квантовой механики. Мы ограничимся качественным рассмотрением межмолекулярных сил различных типов и потом приведем конечный результат: примерную зависимость сил взаимодействия двух молекул от расстояния между ними. Ориентационные силыУ многих молекул, например у молекулы воды, распределение положительных и отрицательных зарядов таково, что в среднем центры этих зарядов не совпадают. Такую молекулу приближенно можно рассматривать как совокупность двух точечных зарядов +q и -q на небольшом расстоянии l друг от друга (рис. 2.7). Эта система зарядов называется электрическим диполем*. Электрические свойства такой молекулы характеризуются дипольным моментом p = ql, (2.4.1) где q—абсолютное значение заряда. * Подробнее об электрических диполях будет рассказано в дальнейшем.
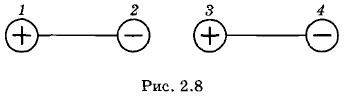
Рассчитывать значения дипольных моментов молекул на первых порах не умели. До создания квантовой механики это вообще было невозможно. Но если считать дипольные моменты p1 и р2 двух молекул известными, то зависимость силы взаимодействия между ними от расстояния можно вычислить. Для этого нужно только знать закон взаимодействия двух точечных электрических зарядов. Этот закон (закон Кулона) уже давно был известен. Сила притяжения двух диполей максимальна, когда они располагаются вдоль одной линии (рис. 2.8). Эта сила возникает из-за того, что расстояние между разноименными зарядами, находящимися в точках 2 и 3, чуть меньше, чем между одноименными, расположенными в точках 1, 3 и 2, 4.
Сила взаимодействия диполей зависит от их взаимной ориентации. Поэтому она называется ориентационной. Хаотическое тепловое движение непрерывно меняет ориентацию молекул-диполей. Учитывая это, силу взаимодействия диполей нужно вычислять как среднюю по всевозможным ориентациям. Расчеты приводят к следующему результату: сила притяжения пропорциональна произведению дипольных моментов p1 и р2 молекул и обратно пропорциональна расстоянию между ними в седьмой степени:
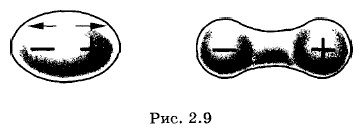
Это очень быстрое убывание по сравнению с силой взаимодействия точечных заряженных частиц, которая пропорциональна Индукционные (поляризационные) силыМожно указать еще одно достаточно простое взаимодействие молекул. Оно возникает между двумя молекулами, одна из которых обладает дипольным моментом, а другая — нет. Дипольная молекула создает электрическое поле, которое поляризует молекулу с электрическими зарядами, равномерно распределенными по объему. Положительные заряды смещаются по направлению линий напряженности электрического поля, а отрицательные — против. В результате неполярная молекула растягивается (поляризуется) и у нее возникает дипольный момент (рис. 2.9).
Силу взаимодействия можно рассчитать и в этом случае. Она пропорциональна дипольному моменту р полярной молекулы, некоторой величине α, характеризующей способность неполярной молекулы поляризоваться (она называется поляризуемостью), и обратно пропорциональна седьмой степени расстояния между молекулами:
Эти силы притяжения называются индукционными или поляризационными, так как они возникают благодаря поляризации молекул, вызванной электростатической индукцией.
|
|
|