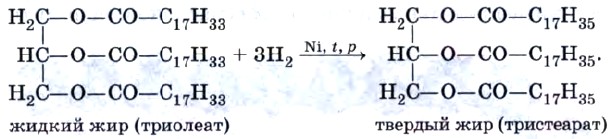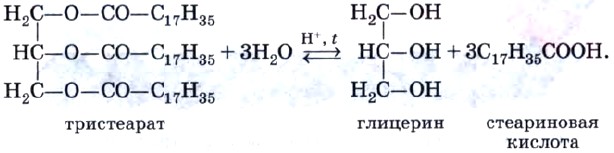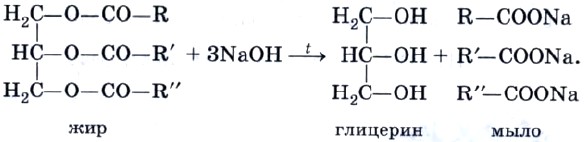|
|
|
|
|
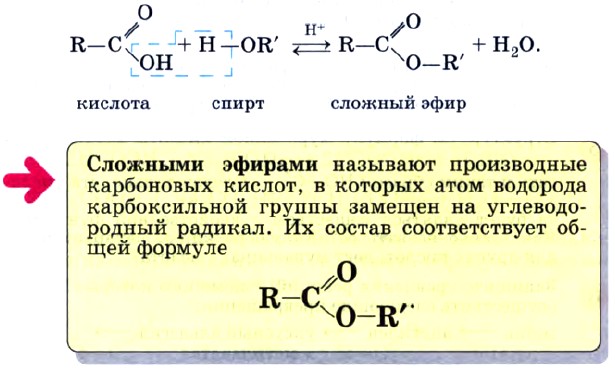
Глава 2. Кислород- и азотсодержащие органические соединения и их природные источники § 13. Сложные эфиры. Жиры. МылаКак вы уже знаете, общим способом получения сложных эфиров является процесс, называемый реакцией этерификации. Еще раз напомним, как записывают уравнение этой реакции в общем виде:
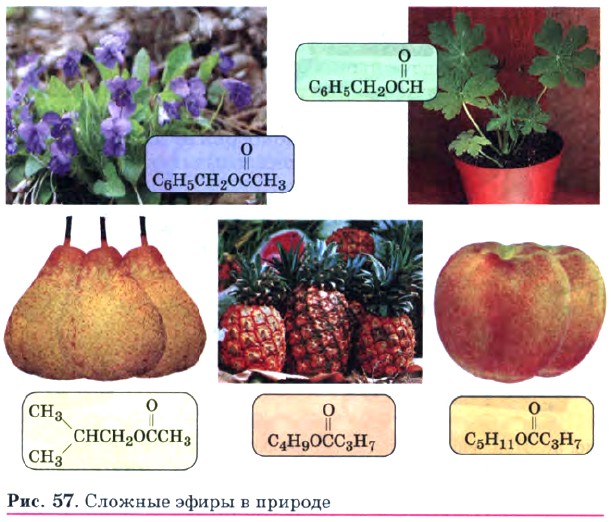
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ — спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции этерификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификации) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира с помощью водоотнимающих средств, например с помощью концентрированной серной кислоты, а в сторону гидролиза сложного эфира — в присутствии щелочи. Сложные эфиры широко распространены в природе. Специфический аромат ягод, плодов и фруктов в значительной степени обусловлен представителями этого класса органических соединений (рис. 57). Сложные эфиры жирных кислот и спиртов с длинными углеводородными радикалами называют восками. Сложные эфиры находят широкое применение в технике и различных отраслях промышленности. Они являются хорошими растворителями органических соединений. Их плотность меньше плотности воды, и они практически не растворяются в ней. Так, сложные эфиры с относительно небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с невысокими температурами кипения, имеют запахи различных фруктов.
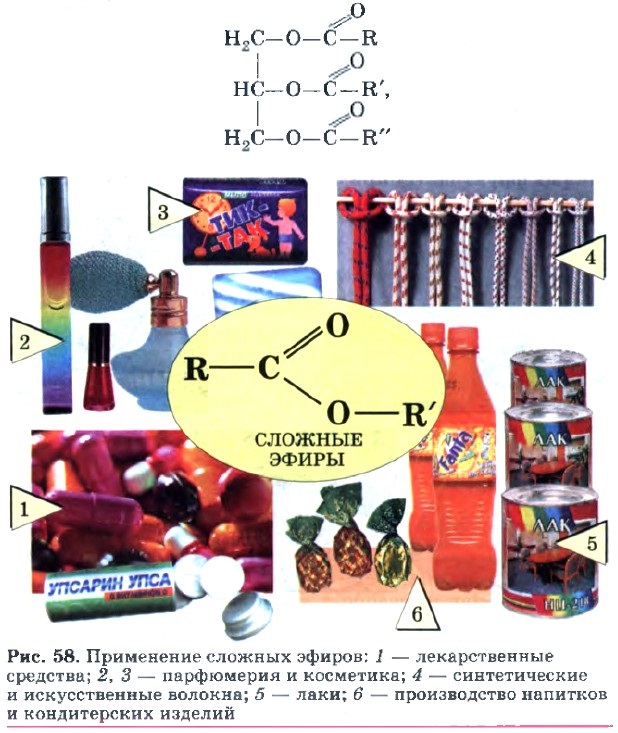
Их применяют как растворители лаков и красок, ароматизаторы изделий пищевой промышленности (рис. 58). Важнейшими представителями природных сложных эфиров являются жиры (рис. 59).
Состав и строение жиров могут быть отражены общей формулой
где R, R', R"— радикалы, входящие в состав высших карбоновых кислот: масляной (—С3Н7), пальмитиновой (—С15Н31), стеариновой (—С17Н35), олеиновой (—С17Н33), линолевой (—С17Н31) и др. В состав жиров могут входить остатки предельных и непредельных кислот, содержащих четное число атомов углерода и неразветвленный углеродный скелет (рис. 60). Природные жиры, как правило, являются смешанными сложными эфирами, т. е. их молекулы образованы различными карбоновыми кислотами. Жиры, образованные предельными кислотами (масляной, пальмитиновой, стеариновой и др.), имеют, как правило, твердую консистенцию.
Это жиры животного происхождения (исключение составляет жидкий рыбий жир). С увеличением длины углеводородного радикала температура плавления жира увеличивается. Если в составе жира содержатся остатки непредельных кислот (олеиновой и линолевой), они представляют собой вязкие жидкости, которые часто называют маслами. Масла — это жидкие жиры растительного происхождения (исключением является твердое пальмовое масло): льняное, конопляное, подсолнечное, оливковое, соевое, кукурузное и др. Жиры нерастворимы в воде, но хорошо растворяются в органических растворителях — бензоле, гексане. Состав жиров определяет их физические и химические свойства. Следует ожидать, что для жиров, содержащих остатки непредельных карбоновых кислот, характерны все реакции этого типа соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Из них наиболее важная в практическом плане реакция — это гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция и лежит в основе получения из растительного масла твердого жира — маргарина. Условно этот процесс можно описать уравнением реакции, например:
Все жиры, как и другие сложные эфиры, подвергаются гидролизу. Например:
Напомним, что гидролиз сложных эфиров — обратимая реакция. Для смещения равновесия в сторону продуктов гидролиза его проводят в щелочной среде (в присутствии щелочей или карбонатов щелочных металлов, например соды Na2CO3). При этом гидролиз протекает необратимо и приводит в результате к образованию не карбоновых кислот, а их солей, которые называют мылами. Поэтому гидролиз жиров в щелочной среде называют омылением жиров. При омылении жиров образуются глицерин и мыла — натриевые или калиевые соли высших карбоновых кислот. Изготовление мыла — один из самых древних химических синтезов. Конечно, этот процесс гораздо «моложе», чем получение этилового спирта. Когда германские племена во времена Цезаря варили козье сало с поташем (техническое название карбоната калия), вымытым из пепла костров, они проводили ту же самую реакцию, которая осуществляется сейчас в грандиозных масштабах современными мыловарами, а именно — щелочной гидролиз жиров (омыление):
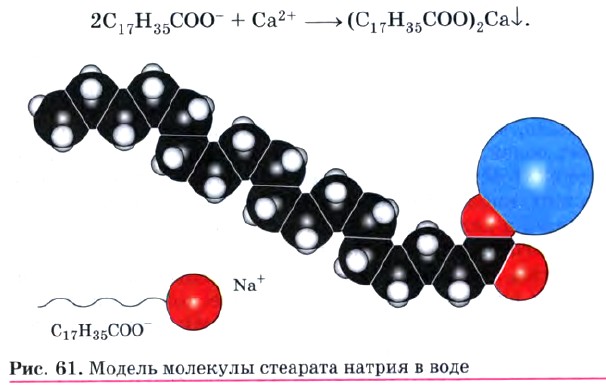
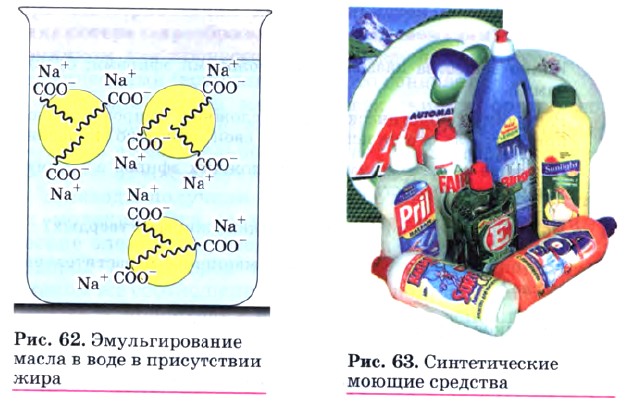
Мыло, которое мы используем, представляет собой смесь солей, поскольку жир, из которого его получают, содержит остатки различных кислот. Натриевые соли высших кислот RCOONa имеют твердое агрегатное состояние, а калиевые RCOOK — жидкое (жидкое мыло). При изготовлении мыла в него добавляют душистые вещества, глицерин, красители, антисептики, растительные экстракты. Однако с химической точки зрения все мыла одинаковы (диссоциируют как сильные электролиты согласно уравнению RCOONa —> RCOO- + Na+) и природа их действия во всех случаях одна и та же. Очищающее действие мыла — сложный процесс. Молекула соли высшей карбоновой кислоты имеет полярную ионную часть (—COO-Na+) и неполярный углеводородный радикал, содержащий 12—18 атомов углерода. Полярная часть молекулы растворима в воде (гидрофильна), а неполярная — в жирах и других малополярных веществах (гидрофобна) (рис. 61). В обычных условиях частицы жира или масла слипаются между собой, образуя в водной среде отдельную фазу. В присутствии мыла картина резко изменяется. Неполярные концы молекулы мыла погружаются в капли масла, а полярные карбоксилат-анионы остаются в водном растворе. В результате отталкивания одноименных зарядов на поверхности масла оно разбивается на мельчайшие частицы, каждая из которых имеет ионную оболочку из анионов —СОО-. Наличие этой оболочки препятствует слиянию частиц, в результате чего образуется устойчивая эмульсия масла в воде. Эмульгирование жира, содержащего грязь, обусловливает очищающее действие мыла (рис. 62). В жесткой воде, содержащей ионы Са2+ и Mg2+, мыло теряет свою моющую способность. Это происходит в результате того, что кальциевые и магниевые соли высших карбоновых кислот нерастворимы в воде:
Вместо пены в воде образуются хлопья осадка, и мыло расходуется бесполезно. Этого недостатка лишены синтетические моющие средства (рис. 63) — современные стиральные порошки. Принцип действия синтетических моющих средств точно такой же, как и у мыла, однако они имеют значительные преимущества. Во-первых, их растворы имеют нейтральную, а не щелочную среду. Во-вторых, синтетические моющие средства сохраняют свое действие в жесткой и даже морской воде, поскольку их кальциевые и магниевые соли растворимы. Вместе с тем остатки стиральных порошков в сточных водах очень медленно разлагаются биологическим путем и вызывают загрязнение окружающей среды.
1. Какие вещества называют: а) сложными эфирами; б) жирами? 2. Раскройте биологическую роль сложных эфиров в живой природе. Для ответа используйте свои знания по биологии. 3. Назовите области применения сложных эфиров в технике и народном хозяйстве. 4. Чем отличаются по строению жидкие жиры от твердых? 5. Как опытным путем различить машинное и растительное масла? 6. Что такое маргарин? Как его получают? 7. Что такое мыла? Как их получают? Почему реакцию щелочного гидролиза жиров называют омылением? 8. Чем отличаются натриевые мыла от калиевых? 9. Какую воду называют жесткой? Какой вред приносит жесткая вода? Как устранить жесткость воды? 10. В чем преимущества синтетических моющих средств (стиральных порошков) перед мылами? В чем их недостатки? 11. В результате реакции этерификации из 150 мл безводной уксусной кислоты (плотность 1 г/мл) получили 200 г этилового эфира уксусной кислоты. Рассчитайте массовую долю выхода продукта реакции от теоретически возможного. 12. Вычислите массу глицерина, которую можно получить из 17,8 кг природного жира, содержащего 97% тристеарата.
|
|
|