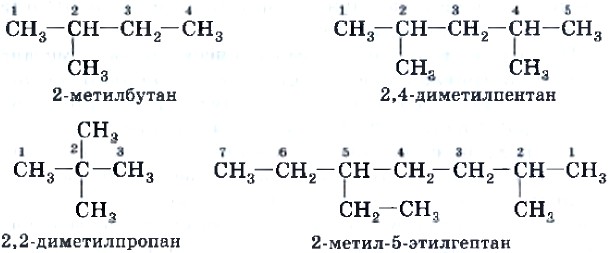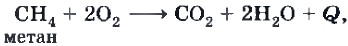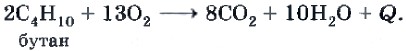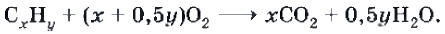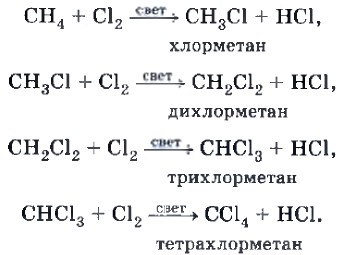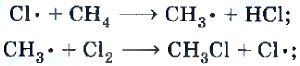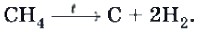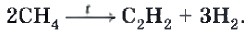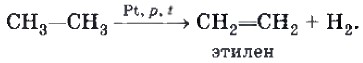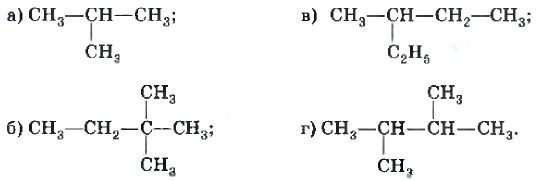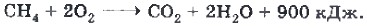|
|
|
|
|
Глава 1. Углеводороды и их природные источники § 3. Природный газ. АлканыВо введении мы определили органическую химию как химию углеводородов и их производных. Название углеводороды говорит за себя: это вещества, молекулы которых состоят из атомов двух химических элементов — углерода и водорода. Благодаря уникальной способности атомов углерода соединяться друг с другом в цепи различной формы и длины, таких соединений существует великое множество. Поэтому их делят на классы. Знакомиться с некоторыми из этих классов мы будем по мере изучения природных источников углеводородов: природного газа и нефти. И это не случайно, ибо наша страна занимает одно из ведущих мест в мире по запасам, добыче, экспорту и переработке углеводородного сырья.
Вместе с тем знание этой темы представляет определенный профессиональный интерес не только для химиков, но также для будущих геологов и географов, юристов и экономистов, обществоведов и политологов, инженеров и экологов. Только детальное владение системой знаний об углеводородном сырье позволит профессионально состояться специалистам, связанным с разведкой, добычей, транспортировкой и промышленной переработкой природного газа (рис. 8) и нефти (рис. 9).
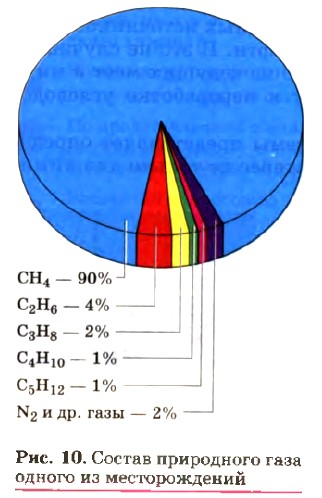
Природные источники углеводородов являются связующим звеном межгосударственных отношений в политической и экономической области и нередко служат причиной конфликтов и войн за контроль над этими источниками. Знакомство с источниками углеводородов мы начнем с природного газа. Это полезное ископаемое — важнейший вид топлива и сырье для химической промышленности, поскольку имеет ряд достоинств: Природный газ — это смесь газообразных углеводородов с небольшой молекулярной массой. Основным компонентом природного газа является метан, доля которого в зависимости от месторождения составляет от 75 до 99% по объему. Кроме метана, в состав природного газа входят этан, пропан, бутан и изобутан, а также азот и углекислый газ (рис. 10). Как вы уже знаете, метан, этан, пропан, бутан являются первыми четырьмя членами гомологического ряда предельных углеводородов — алканов. Свое название «предельные углеводороды» алканы получили потому, что все валентности атомов углерода в этих молекулах насыщены атомами водорода до предела.
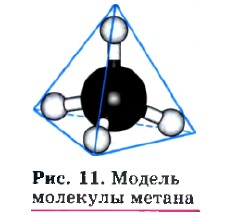
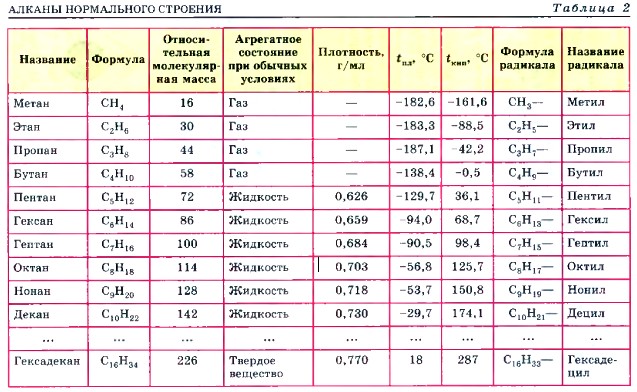
Физические свойства алканов зависят от состава их молекул, т. е. от относительной молекулярной массы, что наглядно иллюстрирует таблица 2. Нетрудно заметить, что с увеличением относительной молекулярной массы у алканов увеличиваются температура кипения и плотность, а также изменяется агрегатное состояние: первые четыре алкана — газообразные вещества, следующие одиннадцать — жидкости, а начиная с гексадекана — твердые вещества. Молекула первого члена гомологического ряда алканов — метана — имеет тетраэдрическое строение, т. е. форму правильной пирамиды (рис. 11). Метан не имеет запаха, поэтому для того, чтобы обнаружить утечку бытового газа, основу которого и составляет метан, к нему добавляют резко пахнущие органические соединения. Если вы почувствуете такой запах, значит, происходит утечка газа и необходимо срочно звонить в аварийную службу горгаза по телефону 04 или в службу МЧС по телефону 01.
Первые четыре члена гомологического ряда метана получили тривиальные, исторически сложившиеся названия. Основой названия следующих алканов нормального строения стали греческие числительные. Так как, начиная с бутана, у каждого алкана с линейной цепью появляются изомеры с разветвленным углеродным скелетом, возникла необходимость выработать систему их названий. Такая система была разработана Международным союзом теоретической и прикладной химии (ИЮПАК) и получила название международной номенклатуры ИЮПАК. Для составления названий органических веществ по номенклатуре ИЮПАК необходимо знать формулы и названия радикалов и других заместителей (например, галогенов). Радикал — это одновалентная частица, которая получается при отщеплении от молекулы алкана атома водорода, т. е. частица, содержащая неспаренный электрон. Название радикала происходит от названия соответствующего алкана с заменой суффикса В соответствии с международной номенклатурой следует придерживаться следующих правил при составлении названия алканов. 1. В структурной формуле выбирают самую длинную цепь атомов углерода (главную цепь). 2. Атомы углерода главной цепи нумеруют, начиная с того конца, к которому ближе разветвление. 3. В начале названия перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствует несколько одинаковых радикалов (два, три, четыре и т. д.), то цифрой указывают место каждого из них в главной цепи и перед их названием ставят соответственно частицы ди-, три-, тетра- и т. д. 4. Основой названия служит наименование предельного углеводорода с тем же числом атомов углерода, что и в главной цепи. Приведем примеры составления названий алканов.
Рассмотрим применение природного газа, в основе которого лежат химические свойства отдельных алканов, в первую очередь метана. Основным химическим свойством предельных углеводородов, определяющим их использование в качестве топлива (рис. 12), является реакция горения:
В общем случае уравнение реакции горения любого углеводорода, имеющего состав СxНy, можно записать в следующем виде:
Однако природный газ — это не только топливо, но и ценное химическое сырье (рис. 13). Его переработка основана на других химических свойствах алканов. Для алканов, как для предельных углеводородов, наиболее характерны реакции замещения.
Так, атомы водорода в молекуле метана способны последовательно замещаться на атомы галогенов, например хлора:
Реакция галогенирования метана протекает по цепному радикальному механизму (т. е. с образованием частиц, содержащих непарный электрон) и состоит из ряда повторяющихся стадий: а) начало цепи, протекает под действием света и называется световой стадией: образуются атомы хлора, имеющие неспаренные электроны (свободные радикалы):
б) рост цепи, может протекать в отсутствие света и называется темновой стадией:
в) обрыв цепи, заключается в рекомбинации (соединении) двух каких-либо свободных радикалов:
За исследование механизма цепных радикальных реакций выдающийся советский физикохимик Н. Н. Семенов (1896—1986) получил Нобелевскую премию. Образующиеся в этих реакциях соединения широко используют как растворители, исходные вещества в органических синтезах, хладагенты (фреоны) в холодильных установках. Метан вступает в реакции полного и неполного разложения в зависимости от условий проведения реакции. При температуре 1000 °С происходит полное разложение метана. При этом образуются сажа и водород:
Сажа идет на изготовление типографской краски и картриджей для принтеров, а водород, например, для производства аммиака. Неполное разложение метана проводят при температуре 1500 °С и резком охлаждении продуктов реакции. В результате этого процесса получают важный углеводород — ацетилен С2Н2, а также водород:
В присутствии катализаторов от молекул алканов отщепляются молекулы водорода.
Например, дегидрированием этана получают этилен — ценный химический продукт:
Этилен и рассмотренный выше ацетилен относят к непредельным углеводородам — алкенам и алкинам. Следующий параграф будет посвящен алкенам — этилену и его гомологам.
1. Укажите важнейшие месторождения природного газа в Российской Федерации. Найдите их на карте полезных ископаемых нашей страны, воспользовавшись географическим атласом. 2. Назовите известные вам международные вооруженные конфликты, которые связаны с контролем над природными источниками углеводородов. 3. Приведите примеры интеграции экономик различных стран, основу которых составляет использование природного газа. 4. Подготовьте рассказ о том, как связаны знания по химии природного газа с вашей будущей профессией. 5. Назовите преимущества природного газа перед другими видами топлива. 6. Проиллюстрируйте закон перехода количественных отношений в качественные на примере гомологического ряда алканов. 7. Назовите углеводороды, структурные формулы которых:
8. Для углеводорода, структурная формула которого
напишите формулы возможных изомеров. Назовите все соединения по международной номенклатуре ИЮПАК. 9. Укажите области применения метана, в основе которых лежит реакция горения. 10. Укажите области применения веществ, образующихся при полном и неполном разложении метана. 11. Укажите области применения соединений, образующихся в реакциях метана с хлором. 12. Вычислите количество теплоты, которая выделится при сгорании 11,2 м3 метана (н. у.), если термохимическое уравнение реакции его горения
|
|
|






 на суффикс
на суффикс 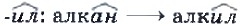 (см. табл. 2).
(см. табл. 2).