|
|
|
|
|
Глава 5. Углеводороды Алкины. Свойства, применение и получение2. Реакции замещенияВ отличие от алкенов алкины вступают в реакции замещения, проявляя слабые кислотные свойства. Атомы водорода, стоящие у атомов углерода, связанных тройной связью, способны замещаться на металл. 1 Аммиачный раствор оксида серебра (реактив Толленса) на самом деле представляет собой щелочной раствор комплексного соединения [Ag(NH3)2]OH.
В сухом виде ацетилениды тяжёлых металлов взрывоопасны.
Алкины с концевой тройной связью проявляют при взаимодействии со щелочами слабые кислотные свойства и способны отщеплять протон под действием сильных оснований. Этим они отличаются от алканов, алкенов и алкинов с тройной связью в середине углеродной цепи. 3. Горение Алкины горят на воздухе сильно коптящим пламенем:
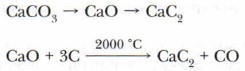
Задание. Дайте объяснение этому явлению. Определите массовую долю углерода в молекуле ацетилена. При горении ацетилена в кислороде достигается очень высокая температура (3150 °С), поэтому ацетилен используется для резки и сварки металлов, на что расходуется до 30 % всего производящегося газа. Хранят ацетилен в растворённом в ацетоне состоянии и транспортируют в баллонах, заполненных пористым наполнителем. Сжиженный ацетилен представляет собой большую опасность, так как может разлагаться со взрывом. Проблема. Как предотвратить взрыв ацетилена при его хранении и использовании? Получение ацетилена.Рассмотрим известные способы получения ацетилена — карбидный способ и пиролиз метана. 1. Карбидный способ. В лаборатории и в промышленности ацетилен можно получать взаимодействием воды с карбидом кальция: СаС2 + 2Н2O — С2Н2 + Са(ОН)2 Главными недостатками карбидного способа получения ацетилена являются большая затрата электроэнергии на стадии производства карбида кальция, многостадийность процесса и высокие капитальные затраты.
2. Пиролиз метана. Начиная с 1970-х годов более 50% ацетилена производится методом пиролиза из углеводородного сырья:
Равновесие химической реакции заметно смещается уже при температуре 1000-1300 °С и выше. При 1500 °С метан практически полностью превращается в ацетилен. Однако при этой температуре ацетилен начинает разлагаться на сажу и водород: С2Н2 → 2С + Н2 Таким образом, образование ацетилена происходит в промежуточной стадии разложения метана. Чтобы осуществить выход ацетилена, необходимо предотвратить его распад. Для этого необходимо уменьшить время пребывания углеводорода в зоне реакции, снижая давление и применяя «закалку» продуктов реакции путём быстрого охлаждения их до температуры, при которой не происходит реакция разложения. Выводы 1. К непредельным углеводородам относятся алкены, алкадиены, алкины. 2. Алкены — непредельные углеводороды, в молекулах которых имеется одна двойная связь. Атомы углерода, соединённые двойной связью, находятся в состоянии sp2-гибридизации. Общая формула — СnН2n. В названии алкенов используется суффикс -ей. Для алкенов характерны: изомерия углеродной цепи, изомерия положения двойной связи, пространственная (геометрическая) изомерия и изомерия между классами. Алкены обладают большой химической активностью. За счёт наличия 7Г-связи алкены вступают в реакции присоединения и полимеризации. 3. Алкадиены — непредельные углеводороды, в молекулах которых имеются две двойные связи. Атомы углерода, связанные двойными связями, находятся в состоянии sр2-гибридизации. Общая формула алкадиенов СnH2n-2 В названии используется суффикс -диен. Характерна изомерия углеродной цепи, положения двойной связи, пространственная (геометрическая) и изомерия между классами. Характерные реакции — присоединения и полимеризации. При полимеризации диеновых углеводородов образуются каучуки, при вулканизации каучука — резина. 4. Алкины — непредельные углеводороды, в молекулах которых имеется одна тройная связь (одна σ-связь и две π-связи). Атомы углерода, связанные тройной связью, находятся в состоянии sp-гибридизации. Общая формула СnH2n-2. В названии используется суффикс -ин. Характерна изомерия углеродной цепи, положения тройной связи и изомерия между классами. Аткины вступают в реакции присоединения и замещения. 5. Для непредельных углеводородов качественной реакцией является обесцвечивание раствора перманганата калия и бромной воды. Основные понятия Реакции присоединения и замещения • Горение алкинов • Ацетилениды • Пиролиз метана Вопросы и задания
а) метан и этан
С2Н2 → С2Н4 → С2Н6
|
|
|



 У гомологов ацетилена, которые имеют у атомов углерода, связанных тройной связью, один атом водорода, замещается на металл только этот последний атом. Гомологи, не имеющие атомов водорода у атомов углерода, связанных тройной связью, не способны давать металлические производные. Так, при пропускании ацетилена через аммиачный раствор оксида серебра выделяется ацетиленид серебра в виде осадка серого цвета:
У гомологов ацетилена, которые имеют у атомов углерода, связанных тройной связью, один атом водорода, замещается на металл только этот последний атом. Гомологи, не имеющие атомов водорода у атомов углерода, связанных тройной связью, не способны давать металлические производные. Так, при пропускании ацетилена через аммиачный раствор оксида серебра выделяется ацетиленид серебра в виде осадка серого цвета:


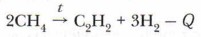
 1. С помощью раствора перманганата калия или бромной воды можно распознать
1. С помощью раствора перманганата калия или бромной воды можно распознать
 2. Запишите уравнения реакций соответственно следующей схеме и укажите условия их осуществления:
2. Запишите уравнения реакций соответственно следующей схеме и укажите условия их осуществления:
 4. Какой объём хлороводорода понадобится для реакции с 10 л ацетилена (н. у.), чтобы получить винилхлорид?
4. Какой объём хлороводорода понадобится для реакции с 10 л ацетилена (н. у.), чтобы получить винилхлорид?