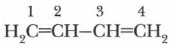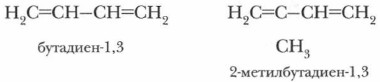|
|
|
|
|
Глава 5. Углеводороды § 16. Алкадиены. Строение, свойства, применение
Алкадиены, или диеновые углеводороды, имеют две двойные связи. Их общая формула СnН2n-2. Две двойные связи в молекуле углеводорода могут располагаться различным образом. а) Две двойные связи сосредоточены у одного атома углерода — кумулированные связи:
б) Две двойные связи разделены одной простой связью — сопряженные связи:
в) Две двойные связи разделены по меньшей мере двумя простыми связями — изолированные связи:
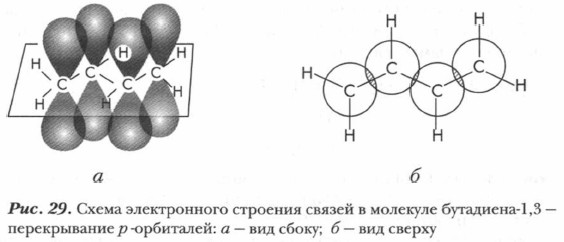
Наиболее важными соединениями являются алкадиены с сопряженными связями. Каждый атом углерода находится в состоянии sр2-гибридизации. Это означает, что у всех атомов углерода имеется по одной негибридизированной 2р-орбитали (рис. 29, см. также рис. 10).
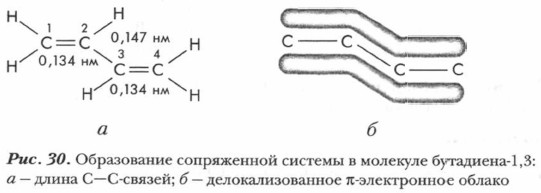
2р-орбиталь атома С1 перекрывается с 2р-орбиталью атома С2, а 2р-орбиталь атома С3 перекрывается с 2р-орбиталью атома С4. Однако и 2р-орбитали атомов С2 и С3 также перекрываются между собой, правда, это перекрывание несколько меньше, чем перекрывание между атомами С1 и С2 и перекрывание между атомами С3 и С4. В результате образуется единое π-электронное облако, распределенное по всей молекуле, создается система сопряженных связей, которую можно представить в виде схемы (рис. 30).
В сопряженной системе π-электроны делокализованы по всем атомам в молекуле (не имеют определенного места), т. е. происходит выравнивание длин связей: двойная связь (0,134 нм) несколько длиннее, чем в этилене, а одинарная (0,147 нм) короче, чем в алканах. Система становится более устойчивой. Это состояние получило название эффекта сопряжения, или мезомерного эффекта. Наибольшее значение из различных представителей диеновых углеводородов имеют бутадиен-1,3 и 2-метилбутадиен-1,3 (изопрен), т. е. алкадиены с сопряженными двойными связями:
|
|
|



 Повторите механизм образования π-связи и ее особенности на примере этилена. В чем отличие sр2-гибридизации от sp3-гибридизации?
Повторите механизм образования π-связи и ее особенности на примере этилена. В чем отличие sр2-гибридизации от sp3-гибридизации?
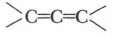
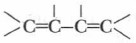
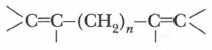
 Рассмотрим электронное строение этих углеводородов на примере молекулы бутадиена-1,3, или дивинила:
Рассмотрим электронное строение этих углеводородов на примере молекулы бутадиена-1,3, или дивинила: