|
|
|
|
|
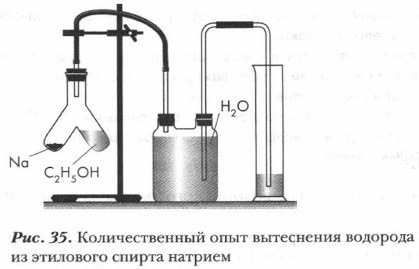
Глава 7. Спирты, фенолы Предельные одноатомные спирты. Гомологический ряд. Состав, строение и физические свойства3. Чтобы доказать, что замещаемый металлом водород принадлежит именно гидроксильной группе, используем количественный опыт. Рассмотрим устройство прибора и то, как связаны между собой его части (рис. 35). Главной частью прибора является реакционный сосуд, представляющий собой пробирку с раздвоением на два колена. В одно колено прибора нальем этиловый спирт, объем которого соответствует массе 2,3 г, что составляет 0,05 моль этого вещества. В другое колено прибора поместим мелкие кусочки натрия (в небольшом избытке). Перельем из первого колена во второе спирт.
Наблюдаем бурную реакцию с выделением водорода. Выделяющийся газ вытесняет воду из двугорлого сосуда в мерный цилиндр. Экспериментально устанавливаем, что выделилось 0,56 л водорода. Сделаем расчеты:
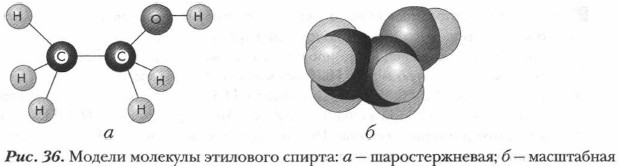
На основе данных опыта и расчетов делаем вывод: из молекулы спирта натрий вытесняет 1 атом водорода. Если условно принять, что этиловый спирт имеет формулу СН3—О—СН3, то непонятно, почему из шести атомов водорода, входящих в состав метиловых групп, замещаются не шесть равноценных атомов водорода, а лишь один. В формуле СН3—СН2—ОН один атом водорода занимает особое место, находясь в составе группы —ОН. Он не связан непосредственно с атомом углерода, как другие атомы водорода, а связан с атомом кислорода функциональной группы и является наиболее подвижным, легко замещаемым на атомы металла. Отсюда вывод: именно формула СН3—СН2—ОН соответствует этиловому спирту. В предыдущем параграфе мы уже рассмотрели электронное строение спиртов и выяснили характер и реакционную способность их молекул. Задание. Составьте электронную формулу пропанола-1, указав смещение электронной плотности в молекуле и ее наиболее реакционноспособные химические связи. Химическое строение предельных одноатомных спиртов передают и их модели. На рисунке 36 представлены разные модели молекул этилового спирта.
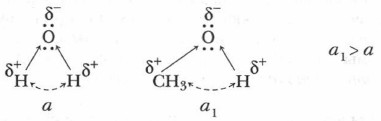
Наиболее реакционноспособной частью молекулы спирта является его функциональная группа, а в ней — химическая связь —О—Н. Самый подвижный атом в молекуле спирта — атом водорода гидроксильной группы. Являясь производными углеводородов, спирты имеют с ними как сходные свойства, так и существенные различия. Это объясняется иным составом и более сложным строением спиртов, а также взаимным влиянием углеводородного радикала и гидроксильной группы друг на друга. Задание. Сопоставьте гомологический ряд метана с гомологическим рядом предельных одноатомных спиртов. Сравните их агрегатные состояния, плотность и температуры кипения. На основании проведенного сравнения можно сделать вывод, что и у спиртов, и у углеводородов наблюдается одна и та же закономерность: с увеличением молекулярной массы температура кипения и плотность увеличиваются. Однако у спиртов более высокая температура кипения, чем у углеводородов с тем же числом атомов углерода. Проблема. Как объяснить сходство и различия в увеличении температур кипения в рядах предельных углеводородов и спиртов? Одноатомные спирты можно рассматривать не только как производные углеводородов у но и как производные воды, в молекуле которой один из атомов водорода замещен на углеводородный радикал. Поэтому имеется некоторое сходство в строении и свойствах у спиртов и воды. Сравним их строение.
Молекулы воды и спиртов имеют угловую форму. Строение спиртов обусловливает их физические свойства: агрегатное состояние, температуру кипения, плотность, растворимость в воде. Обратимся вновь к таблицам гомологических рядов предельных углеводородов и предельных одноатомных спиртов. Проблема. Как объяснить, что первые представители гомологического ряда углеводородов — вещества газообразные, а метанол и этанол — первые гомологи в ряду спиртов — жидкости? Вода имеет молекулярную массу 1 8. В обычном состоянии вода — жидкость. Ее температура кипения 100 °С. Метиловый спирт СН3ОН — жидкость с молекулярной массой 32 и температурой кипения 64,7 °С. Этиловый спирт С2Н5ОН — также жидкость с молекулярной массой 46 и температурой кипения 78,5 °С. Убедиться в различии их температур кипения можно, проведя следующий опыт.
Вывод: tкипСН3ОН < tкип С2Н5ОН < tкип С3Н7ОН < tкип Н2O. В гомологическом ряду спиртов температура кипения повышается с увеличением молекулярной массы.
|
|
|




 Свойства спиртов зависят не только от их состава и строения, но также и от взаимного влияния радикала и функциональной группы друг на друга.
Сравним температуры кипения метилового и этилового спиртов и воды.
Свойства спиртов зависят не только от их состава и строения, но также и от взаимного влияния радикала и функциональной группы друг на друга.
Сравним температуры кипения метилового и этилового спиртов и воды.
 Демонстрационный опыт. В химический стакан нальем глицерин, имеющий температуру кипения 290 "С, и поместим в него четыре пробирки, в которые по 1 мл налиты: метиловый, этиловый, пропиловый спирты и вода. Нагреем глицерин до температуры 110 °С (температуру измерим термометром). Можно наблюдать, что первым закипает метанол, затем — этанол, через определенный интервал — пропанол, позже всех — вода.
Демонстрационный опыт. В химический стакан нальем глицерин, имеющий температуру кипения 290 "С, и поместим в него четыре пробирки, в которые по 1 мл налиты: метиловый, этиловый, пропиловый спирты и вода. Нагреем глицерин до температуры 110 °С (температуру измерим термометром). Можно наблюдать, что первым закипает метанол, затем — этанол, через определенный интервал — пропанол, позже всех — вода.