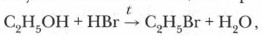|
|
|
|
|
Глава 4. Теоретические основы, механизмы и закономерности протекания реакций органических соединений § 7. Теоретические основы протекания органических реакцийХимические реакции — основной объект науки химии. В процессе химических реакций осуществляется превращение одних веществ в другие, проявляются их химические свойства, синтезируются необходимые человеку новые соединения и материалы, многие из которых не существуют в природе. Реакции с участием органических соединений подчиняются тем же законам (закон сохранения массы и энергии, закон действия масс, закон Гecca и др.) и проявляют те же закономерности (стехиометрические, энергетические, кинетические), что и реакции неорганических веществ. В их описании участвуют общие для неорганической и органической химии понятия — энергия активации, реакционная способность, скорость химической реакции, тепловой эффект реакции, обратимые реакции, катализ, механизм реакции и др. Вместе с тем органические реакции имеют и отличительные особенности. Поскольку органические реакции подчиняются общим теориям и закономерностям протекания химических реакций, из курса химии основной школы необходимо вспомнить следующие общие понятия:
Задание. Каковы причины протекания химических реакций? Раскройте их на примере реакции синтеза воды. Что такое тепловой эффект химической реакции и как он обозначается? На примере горения метана в кислороде раскройте энергетику этого процесса и запишите термохимическое уравнение. Рассмотрим и дополним некоторые теоретические основы протекания реакций органических соединений, на основе которых можно объяснить их сущность, причины и механизмы, предсказать возможность и направления протекания реакций. Органические реакции подчиняются общим законам:
Органические реакции объясняются и прогнозируются положениями электронной теории, энергетики и кинетики химических реакций. Вы уже встречались с понятием «система» и в курсе биологии, и в курсе химии основной школы (в частности, знакомы с молекулой, веществом, раствором как системами). В химии под системой понимают вещество или совокупность веществ, а также их процессы. В химической реакции вещества и их частицы являются реагентами и продуктами реакции. Поэтому химическую систему рассматривают и как реакционную смесь. Химические системы подразделяют на гомогенные и гетерогенные. Гомогенная система — это химическая система, в которой компоненты находятся в одной фазе или в одном агрегатном состоянии (чаще всего жидкой, или газообразной), между компонентами отсутствует граница. Примером может служить состояние веществ в реакции:
где все вещества находятся в жидкой фазе. Гетерогенная система — это химическая система, в которой компоненты находятся в разных агрегатных состояниях (фазах). Границы между фазами называются поверхностями раздела. В отличие от гомогенных реакций, гетерогенные протекают на поверхности раздела между реагентами. Примером может служить состояние веществ в реакции: 2СН3СООН + Mg → (CH3COO)2Mg + Н2↑, где имеют место вещества, находящиеся и в жидкой, и в твердой, и в газообразной фазах. В соответствии с вышесказанным химические реакции, в том числе и каталитические, также делятся на гомогенные и гетерогенные. Гомогенные реакции характеризуются отсутствием поверхности раздела между реагентами, поэтому их взаимодействие протекает по всему объему системы. Реагирующие вещества в гомогенных реакциях находятся в одном агрегатном состоянии. Примером может служить реакция горения метана, где реагенты — газы. Гетерогенные реакции характеризуются наличием поверхностного раздела между реагентами, которые находятся в разном агрегатном состоянии или являются несмешивающимися жидкостями. Например в реакции получения ацетилена из карбида кальция реагенты находятся в твердом, жидком и газообразном состояниях. Величина поверхности раздела влияет на скорость реакции, как и другие факторы.
|
|
|