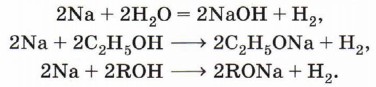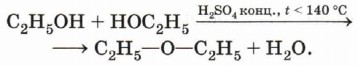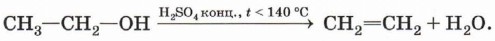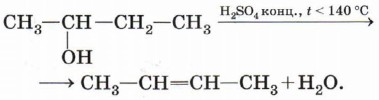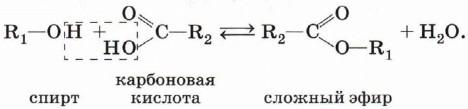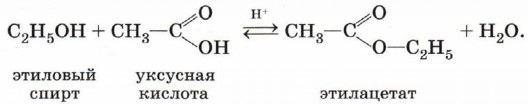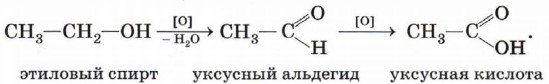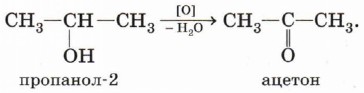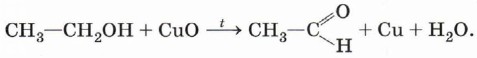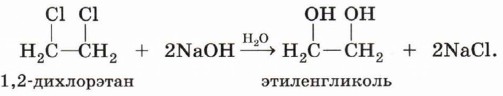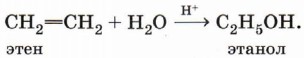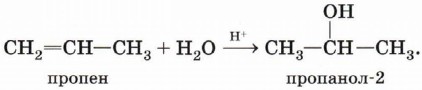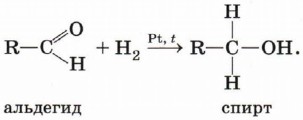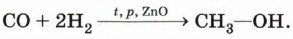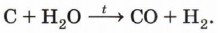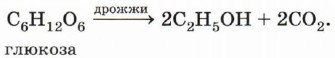|
|
|
|
|
Глава 4. Кислородсодержащие соединения СпиртыХимические свойства спиртовСвойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные радикалы, поэтому химические свойства спиртов определяются взаимодействием и влиянием друг на друга этих групп. Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы. Взаимодействие спиртов с щелочными и щёлочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал, с одной стороны, и вещества, содержащего гидроксильную группу и не содержащего углеводородный радикал, — с другой. Такими веществами могут быть, например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щёлочноземельными металлами (замещаться на них):
С водой это взаимодействие идёт значительно активнее, чем со спиртом, и сопровождается большим выделением теплоты, что может приводить к взрыву. Это различие объясняется электронодонорными свойствами ближайшего к гидроксильной группе радикала. Обладая свойствами донора электронов (+I-эффектом), радикал несколько повышает электронную плотность на атоме кислорода, «насыщает» его за свой счёт, уменьшая тем самым полярность О—Н-связи и кислотный характер атома водорода гидроксильной группы в молекулах спиртов по сравнению с молекулами воды. Алкоголяты щелочных и щёлочноземельных металлов подвергаются необратимому гидролизу при взаимодействии с водой. Например, при растворении этилата натрия в воде реакция протекает согласно уравнению:
Данная реакция подтверждает, что вода по своим кислотным свойствам (кислотному характеру водорода в гидроксильной группе) превосходит спирты. Таким образом, взаимодействие алкоголятов с водой можно рассматривать как взаимодействие соли очень слабой кислоты (в данном случае в этом качестве выступает спирт, образовавший алкоголят) с более сильной кислотой (эту роль здесь играет вода). Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
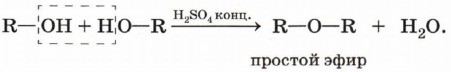
Данная реакция обратима. Межмолекулярная дегидратация спиртов. Отщепление молекулы воды от двух молекул спирта при нагревании происходит в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой в диапазоне температур от 100 до 140 °С образуется диэтиловый (серный) эфир.
Внутримолекулярная дегидратация спиртов. При нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры, чем температура межмолекулярной дегидратации, образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше 140 °С в присутствии концентрированной серной кислоты:
Внутримолекулярная дегидратация спиртов протекает в соответствии с правилом Зайцева: при отщеплении воды от вторичного или третичного спирта атом водорода отрывается от наименее гидрированного атома углерода. Так, при дегидратации бутанола-2 образуется бутен-2, а не бутен-1:
Взаимодействие спиртов с карбоновыми кислотами. В результате реакции образуются сложные эфиры (реакция этперификации):
Например, при взаимодействии этилового спирта и уксусной кислоты образуется уксусно-этиловый эфир — этилацетат (этиловый эфир уксусной кислоты, уксусно-этиловый эфир):
Реакция этерификации катализируется сильными неорганическими кислотами. Окисление спиртов. Обычно окисление спиртов проводят сильными окислителями, например дихроматом калия или перманганатом калия, в кислой среде. При этом действие окислителя направляется на атом углерода, связанный с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
При окислении вторичных спиртов образуются кетоны:
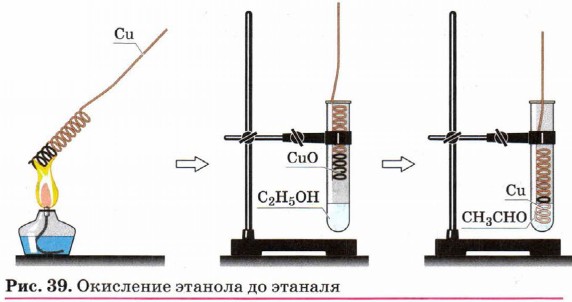
Третичные спирты достаточно устойчивы к окислению. Однако в жёстких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе. На окислении основана одна из качественных реакций на спирты. Если раскалённую в пламени спиртовки спираль из медной проволоки опустить в пробирку со спиртом, чёрный налёт оксида меди со спирали исчезает, восстанавливается характерная красноватая окраска металла (рис. 39). Наблюдаемый аналитический эффект объясняется тем, что оксид меди (II) при нагревании окисляет гидроксильную группу первичных спиртов в альдегидную:
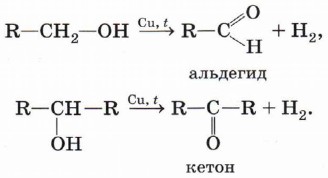
Дегидрирование спиртов. При пропускании паров спирта над металлическим катализатором, например медью, серебром или платиной, нагретым до температуры 200—300 °С, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
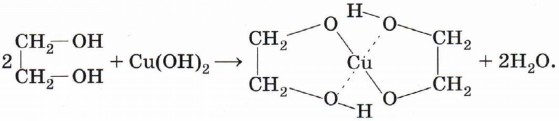
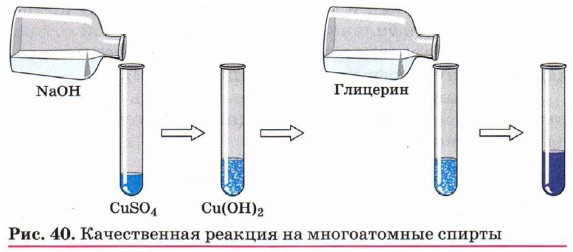
Специфические свойства многоатомных спиртов. Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II) (рис. 40). Например, для этиленгликоля можно записать следующее уравнение:
Одноатомные спирты не способны вступать в эту реакцию, поэтому она является качественной на многоатомные спирты.
Свойства спиртов, обусловленные углеводородным радикалом. Наличие в молекулах спиртов углеводородных радикалов не может не сказаться на химических свойствах спиртов. Химические свойства спиртов, обусловленные углеводородным радикалом, различны и зависят от характера последних. Так, все спирты горят; непредельные спирты, содержащие в молекуле двойную С=С-связь, вступают в реакции присоединения, подвергаются гидрированию, реагируют с галогенами, например обесцвечивают бромную воду, и т. д. Способы получения спиртов Гидролиз галогеналканов. Вы уже знаете, что реакция образования галогеналканов при взаимодействии спиртов с галогеноводородами — обратима. Поэтому понятно, что спирты могут быть получены при гидролизе галогеналканов — реакции этих соединений с водой:
Рассмотрим получение спиртов из галогеналканов гидролизом галогенпроизводных углеводородов. Реакцию обычно проводят в щелочной среде. Выделяющаяся бромоводородная кислота нейтрализуется, поэтому реакция протекает практически до конца: СН3СН2Вг + NaOH → СН3СН2ОН + NaBr. Эта реакция, как и многие другие, протекает по механизму нуклеофильного замещения, основной стадией которых является замещение, протекающее под воздействием нуклеофильной частицы (см. § 9). Многоатомные спирты можно получить при гидролизе галогеналканов, содержащих более одного атома галогена в молекуле. Например:
Гидратация алкенов. Присоединение воды по π-связи молекулы алкена — уже знакомая вам реакция:
Гидратация пропена приводит в соответствии с правилом Марковникова к образованию вторичного спирта — пропанола-2:
Гидрирование альдегидов и кетонов. Вы уже знаете, что окисление спиртов в мягких условиях приводит к образованию альдегидов или кетонов. Очевидно, что спирты могут быть получены при гидрировании (восстановлении водородом, присоединении водорода) альдегидов и кетонов:
Окисление алкенов. Гликоли, как уже отмечалось (см. § 11), могут быть получены при окислении алкенов водным раствором перманганата калия. Например, этиленгликоль (этандиол-1,2) образуется при окислении этилена (этена) на холоду:
Специфические способы получения спиртов. Некоторые спирты получают характерными только для них способами. Так, метанол в промышленности получают при взаимодействии водорода с оксидом углерода (II) (угарным газом) при повышенном давлении и высокой температуре на поверхности катализатора (оксида цинка):
Необходимую для этой реакции смесь угарного газа и водорода, называемую также (подумайте почему!) «синтез-газ», получают при пропускании паров воды над раскалённым углем:
Брожение глюкозы. Этот способ получения этилового (винного) спирта известен человеку с древнейших времён:
|
|
|