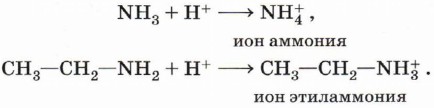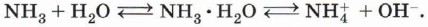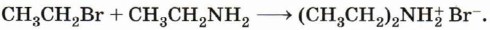|
|
|
|
|
Глава 6. Азотсодержащие соединения АминыХимические свойства аминовХимические свойства аминов определяются в основном наличием у атома азота неподелённой электронной пары. Амины как основания. Атом азота аминогруппы, подобно атому азота в молекуле аммиака, за счёт неподелённой пары электронов может образовывать ковалентную связь по донорно-акцепторному механизму, выступая в роли донора. В связи с этим амины, как и аммиак, способны присоединять катион водорода, т. е. выступать в роли основания:
Как вы уже знаете из курса неорганической химии, реакция аммиака с водой приводит к образованию гидроксид-ионов:
Раствор аммиака в воде имеет щелочную реакцию. Растворы аминов в воде также имеют щелочную реакцию:
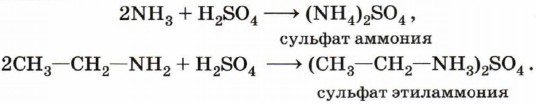
Аммиак, реагируя с кислотами, образует соли аммония. Амины также способны вступать в реакцию с кислотами:
Осно́вные свойства алифатических аминов выражены сильнее, чем у аммиака. Это связано с наличием одного и более донорных алкильных заместителей, положительный индуктивный эффект которых повышает электронную плотность на атоме азота. Повышение электронной плотности превращает азот в более сильного донора пары электронов, что повышает основные свойства амина.
Окисление. Амины горят на воздухе с образованиемуглекислого газа, воды и азота: 4CH3NH2 + 9O2 → 4СO2 + 10Н2O + 2N2. Реакции нуклеофильного замещения. В реакциях нуклеофильного замещения амины вступают в роли нуклеофилов:
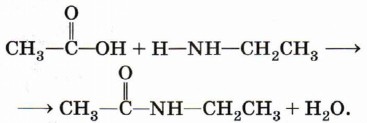
Взаимодействие с карбоновыми кислотами. С производными карбоновых кислот (сложными эфирами, хлорангидридами, ангидридами) амины образуют амиды — важнейший класс органических соединений:
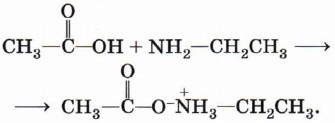
Амид — продукт замещения гидроксила карбоксильной группы на остаток амина. Можно написать формальную реакцию между карбоновой кислотой и амином, которая в результате потери этими веществами воды даёт амид:
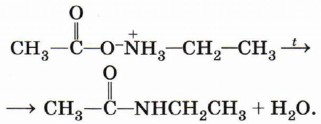
Реально при взаимодействии карбоновой кислоты с амином образуется соль алкиламмония (эта реакция является примером основных свойств амина):
При нагревании аммониевой соли карбоновой кислоты происходит дегидратация и образуется амид:
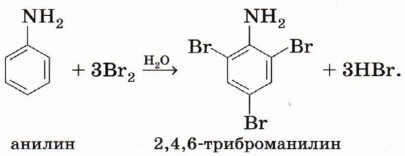
В случае ароматических аминов аминогруппа и бензольное кольцо оказывают существенное влияние друг на друга. Аминогруппа — ориентант I рода. Аминогруппа обладает отрицательным индуктивным эффектом и выраженным положительным мезомерным эффектом (см. § 9 и 14). Таким образом, реакции электрофильного замещения (бромирование, нитрование) будут приводить к орто- и пара-замещённым продуктам:
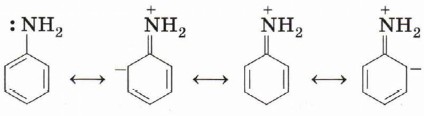
Обратим внимание, что, в отличие от бензола, который бромируется только в присутствии катализатора — бромида железа (III), анилин способен реагировать с бромной водой. Это объясняется тем, что аминогруппа, повышая электронную плотность в бензольном кольце (вспомните аналогичное влияние заместителей в молекулах толуола и фенола), активизирует ароматическую систему в реакциях электрофильного замещения. Кроме того, анилин, в отличие от бензола, немного растворим в воде. Сопряжение π -системы бензольного кольца с неподелённой электронной парой аминогруппы приводит к тому, что анилин является существенно более слабым основанием, чем алифатические амины.
|
|
|