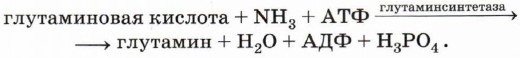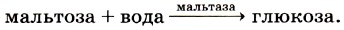|
|
|
|
|
Глава 7. Биологически активные соединения § 30. ФерментыС этим классом биологически активных веществ вы встречались не раз: и в курсе химии 8 класса, когда знакомились с ферментативным катализом, и в курсе биологии 9 класса, изучая пищеварительные ферменты.
Так как реакции обмена веществ, протекающие в живом организме, можно разделить на два типа процессов: синтез (анаболический) и распад (катаболический), то соответственно можно выделить и два типа ферментов. Примером анаболического фермента может служить глутаминсинтетаза:
Примером катаболического фермента может служить мальтаза:
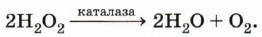
Сейчас химикам известно более 2000 ферментов. Все они обладают рядом специфических свойств, отличающих их от неорганических катализаторов. Свойства ФерментовПонятно, что, будучи по своей природе белками, ферменты должны иметь большие значения молекулярной массы. Действительно, она может колебаться в пределах от 105 до 107, а это значит, что по своему размеру молекулы ферментов попадают в разряд коллоидных частиц. Это не позволяет отнести их ни к гомогенным, ни к гетерогенным катализаторам. Остаётся отнести их к особому классу катализаторов. Каждый фермент ускоряет либо одну реакцию, либо группу однотипных реакций. Эту особенность называют селективностью (избирательностью) действия. Она позволяет организму быстро и точно выполнить чёткую программу синтеза нужных ему соединений на основе молекул пищевых веществ или продуктов их превращения. Располагая богатым набором ферментов, клетка разлагает молекулы белков, жиров и углеводов до небольших фрагментов-мономеров (аминокислот, глицерина и жирных кислот, моносахаридов соответственно) и заново строит из них белковые и иные молекулы, которые будут точно соответствовать потребностям данного организма. Недаром великий русский физиолог И. П. Павлов назвал ферменты носителями жизни. Большинство ферментов обладает очень высокой эффективностью. Скорость некоторых ферментативных реакций может быть в 1015 раз выше скорости реакций, протекающих в их отсутствие. Высокая эффективность ферментов объясняется быстрым восстановлением (регенерацией) молекул в процессе «работы». Типичная молекула фермента может регенерировать миллионы раз за минуту. Например, широко используемый в сыроделии фермент реннин способен вызывать коагуляцию (свёртывание) белков молока в количествах, в миллионы раз превышающих его собственную массу. Этот фермент вырабатывается слизистой оболочкой особого отдела желудка жвачных животных — сычуга. А вот ещё один пример высокой эффективности «работы» фермента, хорошо знакомого вам из курса химии 8 класса, — каталазы. За одну секунду при температуре, близкой к точке замерзания воды, одна молекула этого вещества разлагает около 50 000 молекул пероксида водорода:
Каталаза понижает энергию активации в этой реакции от 75 до 21 кДж/моль. Для сравнения укажем, что применяемая для ускорения этой реакции платина в коллоидном состоянии понижает энергию активации только до 50 кДж/моль. Что же такое энергия активации? Представим себе смесь бензина и кислорода. Реакция между этими веществами возможна, но она не пойдёт без затраты некоторого количества энергии, поступившей, например, в форме простой искры. Энергия, которая необходима для того, чтобы вещества начали взаимодействовать между собой, и называется энергией активации. Чем выше энергия активации, тем ниже скорость реакции при данной температуре. Ферменты, действуя как катализаторы, снижают энергию активации. Они повышают общую скорость реакции, не изменяя в значительной степени температуру, при которой эта реакция протекает. Аналогично «работают» и неорганические катализаторы, но они уступают ферментам в эффективности. Многие ферменты обладают наибольшей эффективностью при температуре человеческого тела, т. е. приблизительно при 37 °С. Неорганические катализаторы сохраняют активность в более широком интервале температур. Например, синтез аммиака проводят при температуре 450—500 °С (катализатор — железо).
|
|
|