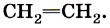|
|
|
|
|
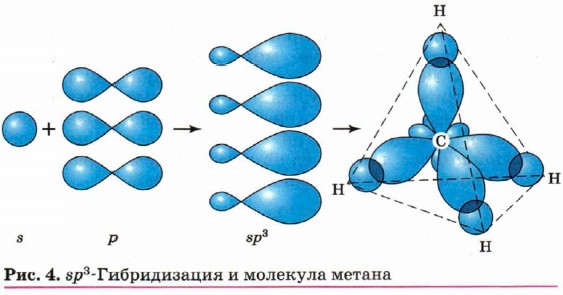
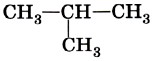
Введение Валентные состояния атома углеродаВ молекуле пропана СН3—СН2—СН3 при центральном атоме углерода находятся два атома водорода и два атома углерода. Такой атом называют вторичным.
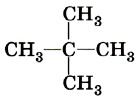
Атом углерода, связанный с тремя углеродными атомами, называется третичным.
Углерод, при котором находятся четыре соседних атома углерода, называется четвертичным.
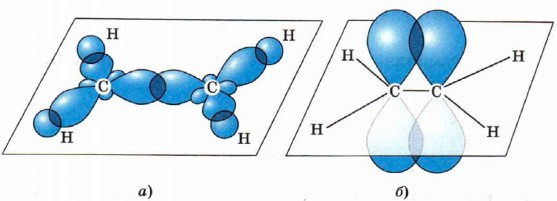
Второе валентное состояние атома углерода рассмотрим на примере молекулы этилена С2Н4. В ней между атомами углерода двойная связь, которая отражается в структурной формуле двумя одинаковыми чёрточками:
Связи, отражённые этими чёрточками, ковалентные, но разные по способу перекрывания: одна из них σ, другая — π. В молекуле этилена каждый атом углерода соединён не с четырьмя, а с тремя другими атомами (с одним атомом углерода и двумя атомами водорода), поэтому в гибридизацию вступают только три электронные орбитали: одна s и две р, т. е. происходит sр2-гибридизация. Оси трёх гибридных орбиталей располагаются в одной плоскости под углом 120° по отношению друг к другу. Орбитали каждого атома углерода перекрываются с s-орбиталями двух атомов водорода и с одной такой же sр2-гибридной орбиталью соседнего атома углерода и образуют три σ-связи под углом 120°. Следовательно, молекула этилена будет иметь плоскостное строение. Две р-орбитали атомов углерода, которые не участвуют в гибридизации, будут перекрываться в двух областях, перпендикулярных плоскости молекулы («боковое» перекрывание), и образуют π-связь (рис. 5).
Однако «боковое» перекрывание р-орбиталей происходит в меньшей степени, чем р-орбиталей по линии связи, и, кроме этого, оно образуется на большем удалении от ядер связывающихся атомов. Поэтому π-связь менее прочна, чем σ-связь. И тем не менее под воздействием π-связи атомы углерода ещё более сближаются друг с другом: в молекуле этана С2Н6 расстояние между ядрами атомов углерода (длина связи) составляет 0,154 нм, а в молекулах этилена С2Н4 — 0,133 нм. Третье валентное состояние атома углерода рассмотрим на примере молекулы ацетилена С2Н2, в которой образуется тройная связь СН≡СН: одна σ-связь и две π-связи. Молекула ацетилена имеет линейное строение, так как в ней каждый атом углерода соединён σ-связями только с двумя другими атомами — атомом углерода и атомом водорода, при этом происходит sp-гибридизация, в которой участвуют лишь две орбитали — одна s и одна р. Две гибридные орбитали ориентируются друг относительно друга под углом 180° и образуют две σ-связи: с s-орбиталью атома водорода и с sp-гибридной орбиталью соседнего атома углерода. Не вступившие в ибридизацию две р-орбитали при боковом перекрывании с подобными орбиталями второго атома углерода образуют две π-связи, расположенные во взаимно перпендикулярных плоскостях (рис. 6).
|
|
|