|
|
|
|
|
Глава вторая. Химические реакции § 15. Скорость химической реакции (продолжение)Впервые в истории Я. X. Вант-Гоффу была вручена Нобелевская премия по химии (1901). Взаимодействия водорода и кислорода 2Н2 + O2 = 2Н2O при комнатной температуре почти не происходит — так мала скорость реакции. При 500 °С эта реакция протекает всего за 50 мин, а при 700 °С она происходит почти мгновенно. Математически правило Вант-Гоффа описывается следующей формулой:
где Правило Вант-Гоффа является приближённым и применяется лишь для ориентировочной оценки влияния температуры на скорость реакции. Эту зависимость также легко проверить опытным путём. Нальём в три химических стакана одинаковые объёмы раствора тиосульфата натрия. Одинаковые объёмы растворов серной кислоты, которые мы одновременно будем приливать в эти химические стаканы из трёх пробирок, нагреем до разных температур: в первой пробирке оставим раствор комнатной температуры (около 20 °С); вторую пробирку нагреем до 40 °С, а третью пробирку нагреем до 70 °С. Нетрудно заметить, что вначале помутнеет раствор тиосульфата натрия, к которому прилили самый горячий раствор серной кислоты, потом — тёплый и, наконец, раствор тиосульфата натрия, к которому прилили раствор серной кислоты комнатной температуры. Скорость химической реакции зависит также от участия в ней катализатора. Обратимся к уже знакомому вам опыту разложения пероксида водорода. Прильём в пробирку немного 3%-го раствора пероксида водорода Н2O2 и подогреем его. Внесём в пробирку с пероксидом водорода тлеющую лучинку — она не вспыхнет, потому что реакция разложения пероксида водорода протекает так медленно, что образующегося небольшого количества кислорода недостаточно, чтобы его обнаружить. Теперь внесём в пробирку немного порошка оксида марганца (IV) МnO2 и заметим, что началось бурное выделение газа, а внесённая в пробирку тлеющая лучинка ярко вспыхнет (рис. 105). Оксид марганца (IV) увеличивает скорость реакции разложения пероксида водорода во много раз. Сам же оксид марганца (IV) по окончании реакции остаётся в таком же количестве, в каком был взят в её начале. Оксид марганца (IV) является катализатором разложения пероксида водорода.
При добавлении катализаторов в смесь реагентов скорость химической реакции увеличивается в десятки и сотни раз, но в итоге реакции сами катализаторы остаются неизменными. Одним из первых исследователей катализа был русский химик Г. И. Гесс, опубликовавший в 1831 г. статью, содержание которой достаточно полно отражено в её названии: «О свойстве весьма мелко раздробленной платины способствовать соединению кислорода с водородом и о плотности платины».
Платина, применяемая в химической промышленности и в наиболее ответственных случаях, является катализатором дорогим, но часто просто незаменимым. Например, с помощью платинового катализатора американским и японским автомобилестроителям удалось добиться почти полного сгорания топлива в двигателях автомобилей, что, в свою очередь, резко уменьшило содержание вредных примесей в выхлопных газах и сделало чище атмосферу таких больших городов, как Токио и Нью-Йорк и др. Слово «катализ» в переводе с греческого означает «разрушение». С помощью катализа происходит как бы разрушение длинного пути, который предстояло пройти веществам, вступившим в реакцию. Катализаторы очень широко используют в химической промышленности, так как они позволяют повысить производительность многих химических процессов, уменьшить стоимость химической аппаратуры, сделать производство экологически более чистым и экономически выгодным.
|
|
|




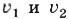 — скорости химической реакции соответственно при температуре t1 и t2; γ — температурный коэффициент, который показывает, во сколько раз увеличится скорость химической реакции с повышением температуры реагирующих веществ на 10 °С.
— скорости химической реакции соответственно при температуре t1 и t2; γ — температурный коэффициент, который показывает, во сколько раз увеличится скорость химической реакции с повышением температуры реагирующих веществ на 10 °С.

