|
|
|
|
|
Глава вторая. Химические реакции § 15. Скорость химической реакцииИзвестно, что одни химические реакции протекают за доли секунды, другие же — за минуты, часы, дни. Например, практически мгновенно протекают реакции, которые сопровождаются взрывом: горение пороха, воспламенение горючей смеси в двигателе внутреннего сгорания автомобиля. При сливании растворов хлорида бария и серной кислоты мгновенно образуется белый осадок сульфата бария: ВаСl2 + H2SO4 = BaSO4↓ + 2НСl. Наоборот, коррозия железа (ржавление) идёт так медленно, что увидеть её продукт можно лишь по истечении длительного времени. Одна и та же реакция может в одних условиях протекать быстро, а в других — медленно. Например, процесс окисления серебра или меди на воздухе тянется годами, а в присутствии озона проходит чрезвычайно быстро. Чтобы характеризовать быстроту протекания химической реакции, используют понятие «скорость химической реакции» (её обозначают латинской буквой
Скорость реакции можно найти по формуле
где C1 и С2 — молярные концентрации реагирующих или образующихся веществ соответственно в момент времени t1 и t2. Если скорость реакции характеризуют изменением молярной концентрации исходных (реагирующих) веществ, то С2 < С1 (концентрация исходного вещества убывает по мере протекания реакции). Так как скорость реакции имеет положительное значение, перед дробью следует поставить знак «минус». При определении скорости реакции по возрастающей концентрации образующихся веществ величина дроби Количество вещества (моль) в единице объёма, как вы помните, называют молярной концентрацией вещества. Её измеряют в моль/л (кмоль/м3, ммоль/мл). Так как время измеряют в секундах (минутах, часах), то единицы скорости химической реакции: 1 моль/(л • с); 1 кмоль/(м3 • мин) и т. д. Следовательно, чтобы определить, с какой скоростью протекает химическая реакция, нужно знать: а) какое количество вещества (моль) образуется (для продукта реакции) или расходуется (для исходного вещества);
Знание скоростей химических реакций имеет очень большое практическое и научное значение. Например, в химической промышленности от скорости химической реакции зависят размеры, производительность аппаратов, количество вырабатываемого продукта и в конечном счёте зарплата работников и себестоимость продукции. Раздел химии, изучающий скорость химических реакций, называют химической кинетикой. Зная её законы, человек получает возможность управлять скоростью химических процессов. При рассмотрении вопроса о скорости реакции необходимо помнить, что реакции делят на гомогенные и гетерогенные.
|
|
|



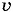 ).
).

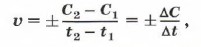
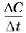 будет положительной.
будет положительной.
