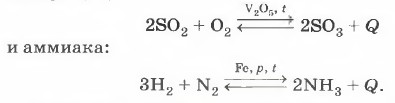|
|
|
|
|
Глава вторая. Химические реакции § 16. Обратимость химической реакции. Химическое равновесие и способы его смещенияПо направлению все химические реакции можно разделить на необратимые и обратимые. К первым относят сравнительно немного реакций. Это, например, реакции горения или реакции в растворах электролитов, протекающие в полном соответствии с правилом Бертолле (вспомните его, приведите примеры).
Гораздо более многочисленную группу составляют обратимые реакции.
Среди обратимых реакций, используемых для получения важнейших химических продуктов, можно назвать реакцию синтеза оксида азота (II), которая может служить началом процесса получения азотной кислоты. Другими, ещё более значимыми реакциями неорганического синтеза являются реакции получения оксида серы (VI):
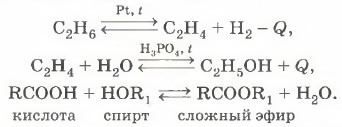
В органической химии обратимые реакции ещё более многочисленны. О многообразии таких реакций говорят хотя бы термины-антонимы, применяемые в ней: гидрирование — дегидрирование, гидратация — дегидратация, этерификация — гидролиз:
В обратимых процессах скорость прямой реакции вначале максимальна, а затем уменьшается из-за того, что уменьшаются концентрации исходных веществ, расходуемых на образование продуктов реакции. Наоборот, скорость обратной реакции, минимальная вначале, увеличивается по мере увеличения концентрации продуктов реакции. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными.
Химическое равновесие является динамичным (подвижным), так как при его наступлении реакция не прекращается, неизменными остаются лишь концентрации компонентов, т. е. за единицу времени образуется такое же количество продуктов реакции, какое превращается в исходные вещества. При постоянных температуре и давлении равновесие обратимой реакции может сохраняться неопределённо долгое время. На производстве же чаще всего заинтересованы в преимущественном протекании прямой реакции. Например, в получении аммиака, оксида серы (VI) и оксида азота (II). Как же вывести систему из состояния равновесия? Как влияет на него изменение внешних условий, при которых протекает тот или иной обратимый химический процесс? Французский химик Анри Ле Шателье в 1885 г. вывел, а немецкий физик Фердинанд Браун в 1887 г. обоСостояние сновал общий закон смещения химического равновесия в зависимости от внешних факторов, который известен под названием принципа Ле Шателье.
|
|
|