|
|
|
|
|
Глава первая. Углеводороды и их природные источники § 3. Ионная химическая связьВ Периодической системе Д. И. Менделеева особняком стоят благородные газы. Это уникальные химические элементы, так как даже в форме простого вещества они существуют в виде отдельных атомов, не связанных друг с другом. Некоторые химики до сих пор затрудняются ответить на вопрос, как рассматривать их частицы в простом веществе: то ли как свободные атомы, то ли как одноатомные молекулы. Аналогично нет однозначного мнения и о том, какой тип кристаллической решётки характерен для простых веществ, образованных этими элементами. По физическим свойствам это вещества с молекулярными кристаллическими решётками. А по составу?.. Ведь силы межмолекулярного взаимодействия, удерживающие частицы в кристаллах, действуют между атомами. Почему же атомы благородных газов так самодостаточны? На основании анализа положения благородных газов в Периодической системе вы сами можете назвать причину этого. Всё дело в том, что атомы благородных газов имеют завершённый внешний электронный слой, на котором у атома гелия находятся два электрона, а у атомов остальных элементов — по восемь. Атомы всех других химических элементов стремятся приобрести именно такую устойчивую электронную конфигурацию и достигают этого либо в результате присоединения электронов от других атомов (как вы, очевидно, знаете, такой процесс в химии называют восстановлением), либо в результате отдачи своих электронов с внешнего уровня другим атомам (процесс окисления). Атомы, присоединившие чужие электроны, превращаются в отрицательные ионы, или анионы. Атомы, отдавшие свои электроны, превращаются в положительные ионы, или катионы. Между катионами и анионами возникают силы электростатического притяжения, которые и удерживают их друг около друга, осуществляя тем самым ионную химическую связь.
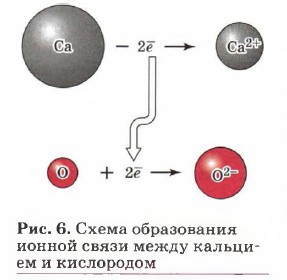
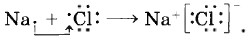
Так как катионы образуют преимущественно атомы металлов, а анионы — преимущественно атомы неметаллов, то логично сделать вывод, что этот тип связи характерен для соединений, образованных типичными металлами (щелочными и щёлочноземельными) и тиличными неметаллами (галогенами, кислородом). Классическим примером веществ с ионной связью являются галогениды и оксиды щелочных и щёлочноземельных металлов (рис. 6). Схему образования ионной связи между атомами натрия и хлора можно представить так:
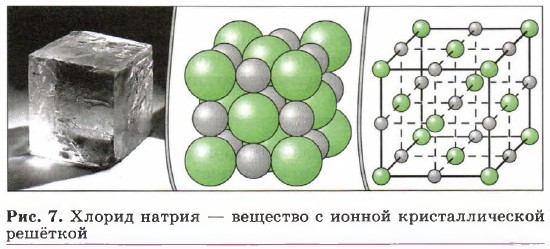
Два разноимённо заряженных иона, связанных силами электростатического притяжения, взаимодействуют с другими противоположно заряженными ионами. В результате образуются кристаллические соединения, которые характеризуются правильным расположением тех частиц (в рассматриваемых выше примерах — ионов), из которых они состоят, в строго определённых точках пространства. Вещества с ионным типом связи имеют ионные кристаллические решётки (рис. 7). Такие соединения представляют собой твёрдые, прочные, нелетучие вещества с высокими температурами плавления. При обычных условиях кристаллы таких веществ электрического тока не проводят, а растворы и расплавы большинства ионных соединений — прекрасные электролиты.
|
|
|