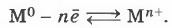|
|
|
|
|
Глава первая. Углеводороды и их природные источники § 5. Металлическая химическая связьАтомы металлов характеризуются тремя особенностями. Они, как правило, имеют 1—3 электрона на внешнем электронном слое. Однако у атомов олова и свинца валентных электронов четыре, у сурьмы и висмута — пять, а у полония — шесть. Почему же эти элементы являются металлами? Очевидно, начинает сказываться вторая особенность в строении атомов металлов — их сравнительно большой радиус. И наконец, атомы металлов имеют большое число свободных орбиталей. Так, у атома натрия, например, один валентный электрон располагается на третьем энергетическом уровне, который имеет девять орбиталей (одну s-, три р- и пять d-орбиталей). При сближении атомов металлов их свободные орбитали перекрываются, и валентные электроны получают возможность перемещаться с орбитали одного атома на свободные и близкие по энергии орбитали соседних атомов. Атом, от которого «ушёл» электрон, превращается при этом в положительно заряженный ион. В результате этого в металле появляются электроны, которые непрерывно перемещаются между ионами. Образование металлической связи условно можно изобразить схемой:
То же самое наблюдается и в металлических сплавах. Металлическая связь неразрывно связана с особым кристаллическим строением металлов и сплавов — металлической кристаллической решёткой, в узлах которой расположены положительно заряженные ионы.
Металлическая кристаллическая решётка и металлическая химическая связь определяют все наиболее характерные физические свойства металлов: ковкость, пластичность, электропроводность, теплопроводность, металлический блеск, способность к образованию сплавов. Пластичность — важнейшее свойство металлов — выражается в их способности деформироваться под действием механической нагрузки. Это важнейшее свойство металлов лежит в основе их обработки давлением (ковки, прокатки и др.), вытягивания из металлов проволоки под действием силы. Пластичность металла объясняется тем, что под внешним воздействием одни слои ионов в кристаллах легко смещаются, как бы скользят друг относительно друга без разрыва связи между ними. Некоторое представление об этом вам может дать простейший опыт-модель. Если между двумя плоскими стеклянными пластинками поместить несколько капель воды, то зеркальца будут легко скользить друг по другу, а вот разъединить их будет достаточно трудно. В нашем опыте вода играла роль совокупности валентных электронов металла.
Наиболее пластичны золото, серебро и медь. Недаром для своего знаменитого опыта, позволившего создать планетарную модель атома, Э. Резерфорд использовал именно золото, из которого можно изготовить тоненькую фольгу толщиной всего 0,003 мм. Такие же тонкие листочки фольги используют для золочения изделий, например деревянной резьбы. Так, в Большом Екатерининском дворце в Царском Селе воссозданная заново знаменитая Янтарная комната потрясает воображение посетителей сиянием золочёной резьбы и мягким солнечным светом янтаря (рис. 16). Художественные изделия из золота, изготовление которых основано на его пластичности, дошли до нас через тысячелетия (рис. 17).
|
|
|