|
|
|
|
|
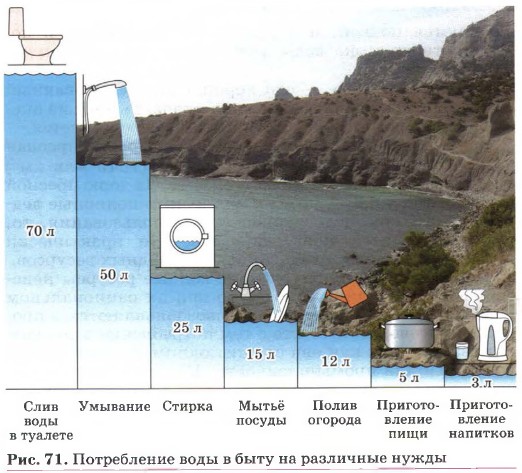
Глава первая. Углеводороды и их природные источники § 9. Жидкие вещества (продолжение)
Содержание таких катионов в воде обусловливают растворимые соединения этих металлов, например соли (хлориды, нитраты, сульфаты). В жёсткой воде мыло не мылится, при стирке белья повышается расход моющих средств, а волосы при мытье секутся. Всё дело в том, что мыла представляют собой натриевые (твёрдые) или калиевые (жидкие) соли жирных кислот, общую формулу которых можно условно записать так: RCOONa или RCOOK. Как и все калиевые и натриевые соли, мыла растворимы в воде и диссоциируют: RCOONa → RCOO- + Na+, чего не скажешь об аналогичных солях кальция, магния и железа. И до тех пор, пока все ионы Са2+ и Mg2+ не будут переведены с помощью мыла в осадок, оно мылить, т. е. стирать и мыть, не будет: 2RCOO- + Са2+ → (RCOO)2Ca↓. В жёсткой воде плохо развариваются мясо и крупы. Этим далеко не исчерпывается список неприятностей, которые приносит человеку жёсткая вода. Загляните внутрь чайника или, если в вашем доме или квартире делали капитальный ремонт, в разрез трубы центрального отопления. Что наблюдаете? Белый, сероватый, рыжеватый рыхлый слой накипи. Оказывается, не только средние растворимые соли кальция, магния и железа являются причиной жёсткости воды, но и особая группа солей, которые называют кислыми.
Такие соли могут дать только многоосновные кислоты, в том числе угольная. Например, вам хорошо известна средняя натриевая соль угольной кислоты — карбонат натрия Na2CO3 (её называют технической содой), продукт полного замещения двух атомов водорода в молекуле угольной кислоты Н2СO3 на натрий. На каждой кухне обязательно имеется ещё одна сода — питьевая, или пищевая. Это кислая соль — гидрокарбонат натрия NaHCO3 — продукт неполного замещения атомов водорода в молекуле угольной кислоты Н2СO3 на натрий. Почему соль называют кислой? Потому что в составе кислотного остатка, как в кислоте, присутствует атом водорода. Аналогично натрию карбонат и гидрокарбонат образуют кальций и магний. Эти соли прекрасно иллюстрируют зависимость свойств веществ от их состава: если гидрокарбонаты хорошо растворимы в воде и диссоциируют, обусловливая тем самым её жёсткость: Са(НСO3)2 = Са2+ + 2НСO-3, то карбонаты нерастворимы. При нагревании воды, содержащей гидрокарбонаты кальция и магния (жёсткой воды), последние превращаются в нерастворимые карбонаты: Са(НСO3)2 = СаСO3↓ + Н2O + CO2↑. Именно они и образуют накипь в чайнике, трубах центрального отопления, паровых котлах и т. д. (рис. 72). Жёсткость воды, обусловленную содержанием в ней гидрокарбонатов кальция, магния и железа и устраняемую кипячением, называют временной. Жёсткость воды, обусловленную содержанием в ней других соединений кальция, магния и железа и кипячением неустраняемую, называют постоянной.
|
|
|