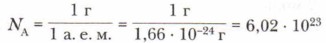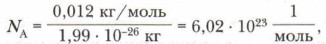|
|
|
|
|
Глава 1. Химические элементы и вещества в свете атомно-молекулярного учения § 15. Количество вещества. Моль — единица количества вещества
До сих пор мы говорили об индивидуальных атомах или молекулах, а также об их массах, измеряемых в атомных единицах массы, или относительных массах. Однако в химической практике невозможно иметь дело с индивидуальными молекулами, и химики взвешивают нужные им вещества в граммах, а не в атомных единицах массы. Чтобы перейти от молекулярной шкалы измерения масс к обычной, воспользуемся единицей измерения, которая называется моль.
Это означает, что 1 моль любого вещества имеет такую массу (в граммах), которая численно равна молекулярной массе данного вещества, выраженной в атомных единицах массы. Например, mм(O2) = 16 а. е. м. • 2 = 32 а. е. м., следовательно, 1 моль кислорода соответствует массе 32 г. Самое важное заключается в том, что
Это число называется постоянной Авогадро. Постоянная названа в честь итальянского химика Амедео Авогадро, очень много сделавшего для утверждения в науке атомно-молекулярного учения. Она обозначается символом NA и выражает отношение единиц, используемых для измерения масс объектов микро- и макромира:
Это очень большое число — 6,02 • 1023. Чтобы как-то представить его, скажем лишь, что оно больше, чем число стаканов воды, которое содержится в Мировом океане, а 6 • 1023 зёрен пшеницы имели бы массу порядка 2 • 1016 т. Для сбора такого урожая потребовалось бы более 2 млн лет. Из примеров ясно: применение числа Авогадро для отсчёта макротел бессмысленно. Главное его назначение — определение количества частиц (атомов, молекул) микромира и связь единиц микро- и макромира. Согласно Международной системе единиц (СИ) моль является единицей измерения особой физической величины — количества вещества. Под количеством вещества (обозначается латинской буквой n) понимают число структурных единиц этого вещества (атомов, молекул и др.). Моль — это количество вещества, содержащее столько структурных единиц (атомов, молекул), сколько содержится атомов в 0,012 кг углерода:
где 1,99 • 10-26 кг — масса одного атома углерода. Зная количество вещества, можно судить о числе частиц в определённой его порции и брать вещества для реакций в необходимых количествах, т. е. химики могут определять число атомов и молекул путём взвешивания порций веществ. Приведём примеры таких расчётов.
|
|
|



 Дайте определения относительным атомной и молекулярной массам. Рассчитайте относительную молекулярную массу молекул воды, сероводорода H2S, аммиака NH3 хлороводорода НСl. В каких единицах она измеряется? Почему для измерения масс атомов и молекул потребовалась особая единица?
Дайте определения относительным атомной и молекулярной массам. Рассчитайте относительную молекулярную массу молекул воды, сероводорода H2S, аммиака NH3 хлороводорода НСl. В каких единицах она измеряется? Почему для измерения масс атомов и молекул потребовалась особая единица?
 Моль — это количество вещества, содержащее такое число молекул, которое совпадает с числом атомов в 0,012 кг изотопа углерода-12.
Моль — это количество вещества, содержащее такое число молекул, которое совпадает с числом атомов в 0,012 кг изотопа углерода-12.