|
|
|
|
|
Глава 5. Понятие о газах. Воздух. Кислород. Горение Кислород — химический элемент и простое вещество. Получение кислорода в лаборатории
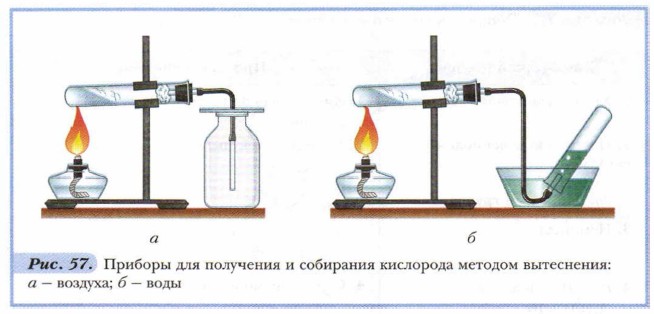
Какие способы являются химическими, какие — физическими? Как убедиться в том, что сосуд наполнен кислородом? Мы уже знаем, что раньше других был изобретён химический способ получения кислорода из его соединений. Один из наиболее простых и доступных его вариантов — нагревание перманганата калия (рис. 57). При этом происходит реакция (термическое разложение), сущность которой может быть выражена следующим уравнением:
Для определения особенностей устройства прибора, в котором будем получать кислород, рассчитаем относительную плотность кислорода по воздуху: Dвозд(О2) = Мr(O2) : Мr(возд.) = 32 : 29 ≈ 1,1 Итак, кислород немного тяжелее воздуха. Значит, его можно собрать в сосуд методом вытеснения воздуха — кислород будет собираться на дне сосуда. Пробирку с нагреваемым перманганатом калия следует укрепить почти горизонтально (рис. 57, а). Кислород весьма ограниченно растворяется в воде. Следовательно, собирать его можно также методом вытеснения воды (рис. 57, б). Кислород можно получать также и разложением других соединений в присутствии катализаторов. Катализаторами называются вещества, которые ускоряют ход химической реакции, но сами при этом не расходуются. Реакции, протекающие с участием катализаторов, называются каталитическими. Примером такой реакции является получение кислорода из бертолетовой соли (хлорат калия), где катализатором служит оксид марганца(IV) МnO2:
Для интенсивного протекания реакции бертолетова соль должна быть нагрета до 400 °С. В присутствии катализатора — оксида марганца (IV) её бурное разложение начинается уже при 200 °С. Этот же катализатор ускоряет уже известную вам реакцию разложения пероксида водорода:
В присутствии катализатора реакция протекает без нагревания. Достаточно в стакан с раствором пероксида добавить немного чёрного порошка катализатора (оксида марганца (IV)), как жидкость тотчас вспенивается вследствие бурного выделения кислорода.
Основные понятия Химический элемент • Простое вещество • Термическое разложение • Катализатор • Каталитическая реакция Вопросы и задания
Если бы стоимость всех перечисленных веществ была одинаковой, применение какого из них оказалось бы наиболее выгодным?
|
|
|



 Какой из перечисленных способов был изобретён ранее других?
Какой из перечисленных способов был изобретён ранее других?


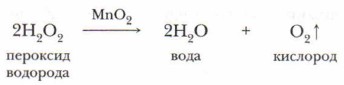
 1. Рассчитайте массовые доли кислорода в соединениях, использующихся для его получения: Н2O2, HgO, КМпO4, КСlO3.
1. Рассчитайте массовые доли кислорода в соединениях, использующихся для его получения: Н2O2, HgO, КМпO4, КСlO3.
 2. Определите массу каждого вещества, которое следует подвергнуть разложению, чтобы получить 64 г O2: а) КСlO3; б) HgO: в) КМnO4.
2. Определите массу каждого вещества, которое следует подвергнуть разложению, чтобы получить 64 г O2: а) КСlO3; б) HgO: в) КМnO4.
 4. Как известно, рыбы дышат кислородом, растворённым в воде. Что можно сказать о требовательности к содержанию кислорода в воде таких известных видов рыб, как карась и форель, если первый предпочитает стоячую воду небольших прудов, а вторая водится только в быстрых горных речках?
4. Как известно, рыбы дышат кислородом, растворённым в воде. Что можно сказать о требовательности к содержанию кислорода в воде таких известных видов рыб, как карась и форель, если первый предпочитает стоячую воду небольших прудов, а вторая водится только в быстрых горных речках?