|
|
|
|
|
Глава 8. Периодический закон и периодическая система Д.И. Менделеева § 42. Периодическая система в свете теории строения атома
Периодичность в изменении свойств элементов позволила Д.И. Менделееву выделить периоды элементов, которые он расположил друг под другом по возрастанию порядковых номеров элементов.
Таким образом, по своей структуре периодическая система представляет собой матрицу, состоящую из семи периодов и восьми групп. Каждый элемент в периодической системе занимает в соответствии с порядковым номером определённое место в определённом её периоде и определённой группе. Рассмотрим периодическую систему с позиций теории строения атома. Атомы элементов одного периода имеют одинаковое число энергетических уровней, равное номеру периода, но при одинаковом числе энергетических уровней у атомов элементов одного и того же периода число электронов на внешнем уровне разное: оно постепенно возрастает (от 1 до 8). Увеличение Z и числа электронов на внешнем слое атомов обусловливает уменьшение радиуса атомов и изменение свойств элементов в периоде. Металлические свойства элементов ослабевают, неметаллические усиливаются: высшая валентность элементов в кислородных соединениях возрастает от 1 до 7, валентность элементов-неметаллов уменьшается от 4 до 1. Изменение характера оксидов и гидроксидов элементов в периоде отражает следующая схема.
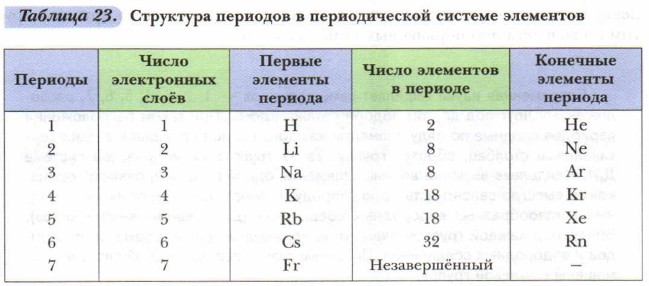
Каждый период (кроме первого) начинается металлическим элементом (щелочным металлом) и оканчивается инертным газом. Задание. Обратите внимание на число элементов в каждом периоде. На основании современного варианта периодической таблицы установите взаимосвязь между числом элементов в разных периодах и закономерностью заполнения электронами внешних и пред- внешних энергетических уровней их атомов. Полученные данные обобщим в виде таблицы 23.
Периоды по количеству элементов в них делятся на малые и большие. Малые периоды (с 1-го по 3-й) Д.И. Менделеев называл ещё типическими, поскольку в них наиболее отчётливо прослеживаются типичные изменения свойств элементов.
Всё изложенное позволяет дать определение понятия «период».
В периодической системе выделены также вертикальные ряды элементов — группы. |
|
|



 Что вам известно о значении периодической системы? Как устроена периодическая система?
Что вам известно о значении периодической системы? Как устроена периодическая система?

 Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания зарядов ядер их атомов. Они имеют одинаковое число электронных слоёв, но разное число валентных электронов. Период начинается щелочным металлом (кроме 1-го) и заканчивается инертным газом.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания зарядов ядер их атомов. Они имеют одинаковое число электронных слоёв, но разное число валентных электронов. Период начинается щелочным металлом (кроме 1-го) и заканчивается инертным газом.