|
|
|
|
|
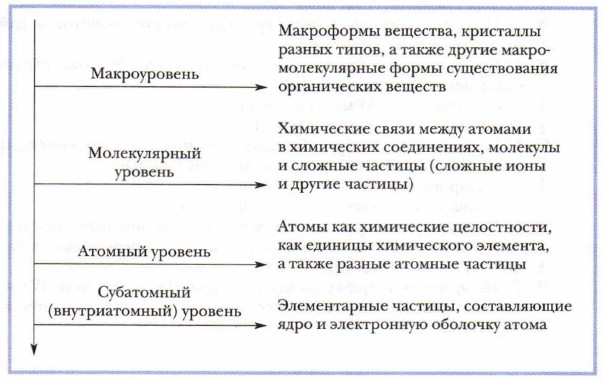
Дополнительный материал к главе 9 Химическая организация веществ и её уровниКаждое вещество представляет собой единство микромира и макромира. Микромир его представлен элементарными частицами: атомами, ионами и другими мельчайшими объектами, которые подчиняются законам микромира. Вместе с тем, работая в химической лаборатории, мы имеем дело с реальными видимыми веществами, можем наглядно изучать их свойства, наблюдать реакции, в которые вступает вещество. Это макроформа вещества, это видимая часть айсберга, называемого веществом. Микроформа — его внутренняя невидимая часть. Мы представляем её с помощью моделей строения. Совокупность всех частиц (малых и больших), составляющих вещество, их разные комплексы, их взаимосвязи определяют химическую организацию вещества. Можно условно выделить следующие уровни химической организации веществ.
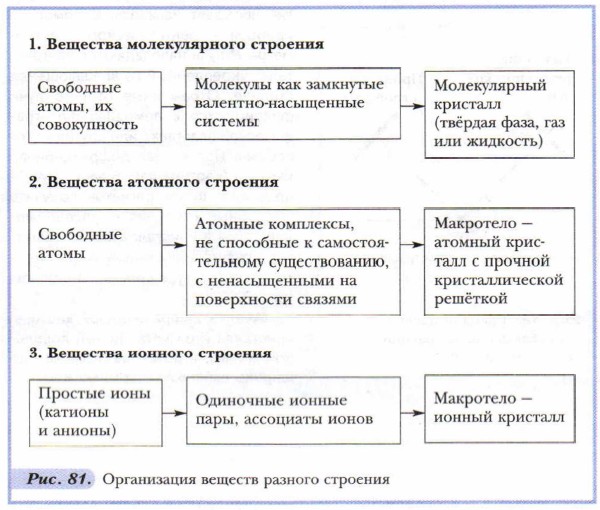
Любую частицу, любой уровень организации вещества и вещество в целом следует рассматривать и описывать с позиций идеи взаимосвязи состава, строения и свойств. Субатомный уровень вещества — это преимущественно объект изучения физики. Остальные уровни изучает как физика, так и химия. Наиболее значима для химика электронная структура атома, так как именно ею обусловлена его способность образовывать химические связи с другими атомами. Энергия ионизации, сродство к электрону, атомная масса, валентность, степень окисления, электроотрицательность — эти характеристики атома элемента необходимы для описания его состава, строения и свойств как вещества. Молекулярный уровень характеризует состав, строение и свойства отдельных молекул и других атомных частиц. При характеристике химической организации веществ на этом уровне главное значение придаётся их составу и химическим связям, лежащим в основе образования химического соединения. В зависимости от них рассматриваются реакционная способность молекулярных частиц и их свойства. На макроуровне химической организации вещества рассматриваются с позиции их агрегатного состояния. Ведущее значение здесь имеет кристалл, кристаллическая решётка. В зависимости от агрегатного состояния и кристаллической структуры описываются свойства веществ. Агрегатные состояния и переходы веществ влияют на их свойства. Так, например, в парообразном состоянии некоторые металлы и химические соединения — молекулярные вещества, а при конденсации их в твёрдую форму меняются их структура и свойства. Пары́ металлов конденсируются в металлические кристаллы с характерными для этих веществ свойствами (металлический блеск, электрическая проводимость и др.), а молекулы хлорида фосфора(V) РСl5 — в ионные соединения с новыми свойствами, присущими последним. От уровня к уровню наблюдается усложнение химической организации веществ (см. рис. 81).
Для твёрдых кристаллических веществ характерна плотная упаковка их частиц (молекул, атомов, ионов) в кристалле, т. е. эти частицы упорядочены в пространственной структуре кристалла.
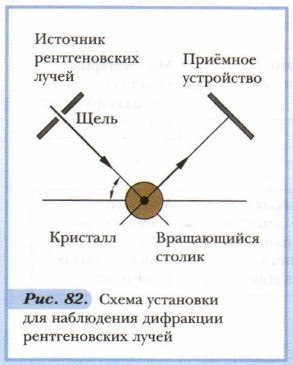
Однако существуют и такие твёрдые вещества, у которых составляющие их частицы недостаточно упорядочены. Такие твёрдые вещества называются аморфными. Примером их служат стекло и многие известные вам полимеры. Методы исследования структуры кристаллов — предмет науки кристаллографии. Наиболее распространённым экспериментальным методом установления их структуры является рентгеноструктурный анализ. Он основан на изучении характера рассеивания (дифракции) рентгеновских лучей, направляемых на исследуемый кристалл, которые частично поглощаются кристаллом и, попадая на его плоскости, отражаются в определённых направлениях, другие проходят насквозь. С помощью прибора — рентгеновского спектрометра R-лучи направляются на кристалл, укреплённый на вращающемся столике. Отражённые от него лучи фиксируются с помощью фотографической пластинки или другими способами. Полученная дифракционная картина (картина рассеивания лучей) позволяет путём расчётов получить подробные сведения о расположении узлов в кристаллической решётке, о расстояниях между её плоскостями, о структуре кристалла в целом (рис. 82). Анализ дифракционной картины кристалла и расчёты по ней довольно сложны, и потому в этом методе широко используют компьютеры.
|
|
|