|
|
|
|
|
Глава 11. Водород — рождающий воду и энергию § 53. Вода — оксид водорода. Пероксид водорода (окончание)Итак, молекула воды полярна (диполь). Этим объясняется её универсальная способность к растворению всех веществ, имеющих полярное строение. Мы уже вспоминали, что во времена алхимии было сформулировано «золотое правило» растворения: подобное растворяется в подобном. Вода блестяще подтверждает это правило: в ней растворяются оксиды, кислоты, соли, щёлочи — вещества, для которых характерна ионная или полярная ковалентная связь. Химические свойства воды1. Взаимодействие воды с металлами. Эти реакции относятся к окислительно-восстановительным. При комнатной температуре с водой реагируют лишь наиболее активные — щелочные и щёлочноземельные — металлы: 2Na + 2H2O = 2NaOH + H2↑
При нагревании в реакцию с водой вступают магний и цинк:
Алюминий будет взаимодействовать только после удаления с его поверхности оксидной плёнки: 2Аl + 6Н2O = 2Аl(ОН)3↓ + ЗН2↑ Железо вступает в реакцию с водой только при температуре красного каления, образуя оксид металла:
2. Вода взаимодействует с растворимыми кислотными оксидами с образованием соответствующих кислот: а) ЗН2O + Р2O5 = 2Н3РO4
3. Вода взаимодействует с оксидами щелочных и щёлочноземельных металлов с образованием растворимых или малорастворимых в воде оснований: а) Na2O + Н2O = 2NaOH
Основные понятия Строение молекулы воды • Химические свойства воды Вопросы и задания
|
|
|



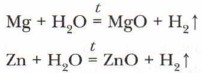
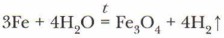
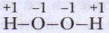
 1. Как можно ускорить реакцию разложения пероксида водорода? Как называются вещества, ускоряющие протекание реакций?
1. Как можно ускорить реакцию разложения пероксида водорода? Как называются вещества, ускоряющие протекание реакций?
 2. Составьте сравнительную таблицу: состав и свойства кислородных соединений водорода. Обсудите её с товарищем.
2. Составьте сравнительную таблицу: состав и свойства кислородных соединений водорода. Обсудите её с товарищем.
 3. Примите участие в подготовке и защите проекта на тему «Проблема чистой воды в вашей местности». Проведите исследования проб воды из различных источников (под руководством учителя).
3. Примите участие в подготовке и защите проекта на тему «Проблема чистой воды в вашей местности». Проведите исследования проб воды из различных источников (под руководством учителя).