|
|
|
|
|
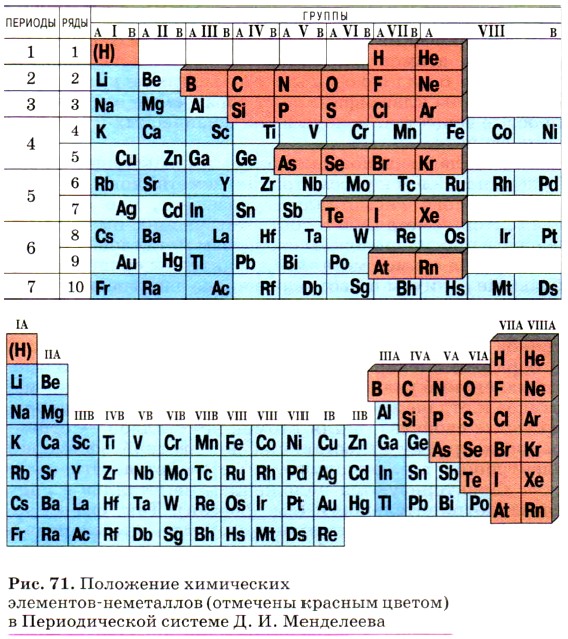
Глава 3. Неметаллы § 18. Неметаллы: атомы и простые вещества. Кислород, озон, воздухВсе химические элементы в зависимости от строения и свойств атомов разделяют на металлы, неметаллы и благородные газы. Также на металлы и неметаллы классифицируют образуемые элементами простые вещества, исходя из их физических и химических свойств. С металлами вы познакомились в предыдущей главе. Теперь перейдём к рассмотрению неметаллов. Само слово «неметаллы» указывает, что свойства элементов-неметаллов и соответствующих им простых веществ противоположны свойствам металлов. Если для атомов металлов характерны сравнительно большие радиусы и небольшое число электронов (1—3) на внешнем уровне, атомам неметаллов, наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем энергетическом уровне от 4 до 8 (у бора этих электронов 3, но атомы этого элемента имеют маленький радиус). Отсюда и стремление атомов металлов к отдаче внешних электронов, т. е. восстановительные свойства, а для атомов неметаллов — стремление к приёму недостающих до заветной восьмёрки электронов, т. е. окислительные свойства. Эти свойства характеризуются положением неметаллов в ряду электроотрицательности (см. форзац). Так, фтор проявляет только окислительные свойства, а кислород — восстановительные свойства исключительно по отношению к фтору и т. д. Среди 114 известных сегодня химических элементов (из них 92 элемента найдены в природе) к неметаллам относят 22 элемента. О расположении металлов и неметаллов в Периодической системе Д. И. Менделеева мы уже рассказывали в предыдущей главе. Здесь ещё раз отметим, что в Периодической системе Д. И. Менделеева металлы расположены в основном под диагональю В—At, а неметаллы — по этой диагонали и над ней в главных подгруппах (рис. 71). Свойства простых веществ, образуемых неметаллами, отличаются большим разнообразием. Хотя по сравнению с металлами неметаллов гораздо меньше, для них трудно выделить общие характерные признаки.
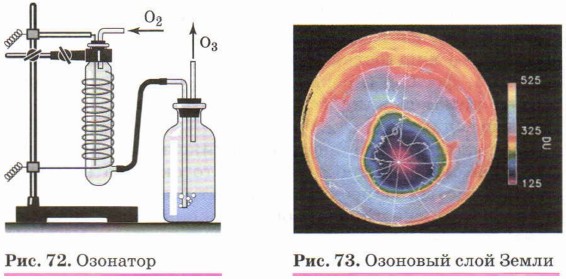
Судите сами: водород Н2, кислород O2 и озон O3, фтор F2, хлор Сl2, азот N2 — газы при обычных условиях, бром Вг2 — жидкость, а бор, углерод (алмаз и графит), кремний, фосфор (красный и белый), сера (пластическая и ромбическая), селен, теллур, иод I< sub>2, астат — твёрдые вещества. Если для подавляющего большинства металлов характерен серебристо-белый цвет, то окраска неметаллов — простых веществ охватывает все цвета спектра: красный (красный фосфор, красно-бурый жидкий бром), жёлтый (сера), зелёный (хлор — жёлто-зелёный газ), фиолетовый (пары иода). Температуры плавления неметаллов лежат в очень широком интервале: от 3800 °С у графита до -259 °С у водорода. Эта особенность свойств неметаллов является следствием образования ими двух типов кристаллических решёток: молекулярной (O2, O3, N2, галогены, белый фосфор и др.) и атомной (алмаз, графит, кремний, бор и др.). Разным строением кристаллических решёток объясняется и явление аллотропии (вспомните, что это такое). Например, элемент фосфор образует простое вещество с молекулярной кристаллической решёткой — белый фосфор, молекулы которого имеют состав Р4, и простое вещество с атомной кристаллической решёткой — красный фосфор Р. Вторая причина аллотропии связана с разным числом атомов в молекулах простых веществ. Типичный пример — простые вещества, образуемые кислородом: кислород O2 и озон O3. В отличие от бесцветного кислорода O2, не имеющего запаха, озон — это светло-синий газ с сильным запахом. Вы уже знаете из курса прошлого года, что примесь озона в воздухе, появляющаяся после грозы, даёт ощущение приятной свежести; содержится озон и в воздухе сосновых лесов и морского побережья. В природе озон образуется при электрических разрядах или окислении органических смолистых веществ, а также при действии ультрафиолетовых лучей на кислород. В лаборатории его получают в специальных приборах — озонаторах (рис. 72) при действии на кислород тихим (без искр) электрическим разрядом.
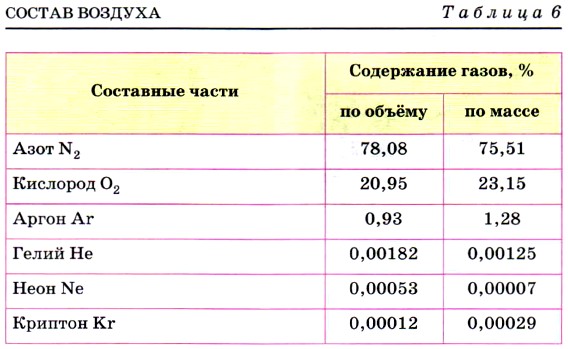
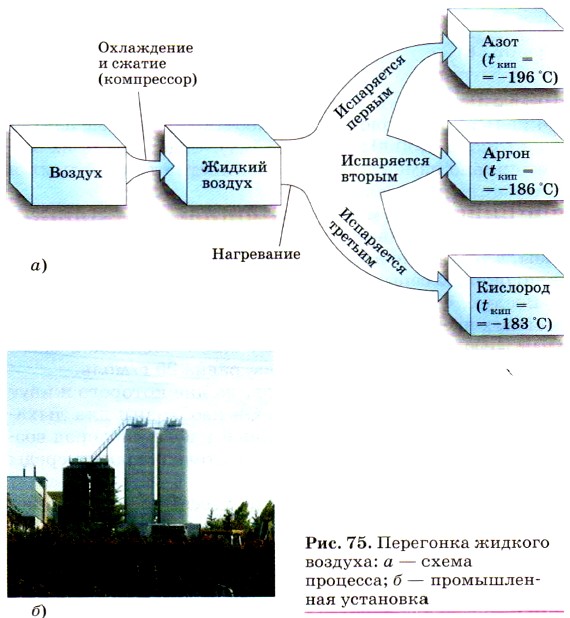
Озон — гораздо более сильный окислитель, чем кислород. На сильной окислительной способности озона основано его применение: отбеливание тканей, дезодорирование (удаление запаха) жиров и масел, обеззараживание воздуха и питьевой воды. Озон имеет очень большое значение для сохранения всего живого на нашей планете. Напомним, что озоновый слой Земли (рис. 73), расположенный на высоте 20—25 км, задерживает ультрафиолетовое излучение, которое разрушающе действует на клетки живых организмов. Поэтому понятно, как важно сохранить этот весьма чувствительный к действию различных химических веществ «озоновый щит» планеты от разрушения. Озон относят к переменным составляющим воздуха. Ещё в конце XVIII в. А. Лавуазье установил, что воздух — это не простое вещество, а смесь газообразных неметаллов: азота N2 (на его долю приходится 4/5 объёма воздуха) и кислорода O2 (с объёмной долей 1/5). В дальнейшем представления о составе воздуха были уточнены. В настоящее время различают постоянные, переменные и случайные составные части воздуха. Постоянные составные части воздуха — это азот, кислород и благородные газы (аргон, гелий, неон и т. п.). Содержание их в тропосфере одинаково (табл. 6).
Переменные составные части воздуха — это углекислый газ (около 0,03% по объёму), водяные пары и озон (около 0,00004% по объёму). Содержание их может сильно изменяться в зависимости от природных и промышленных условий. К случайным составным частям воздуха относят пыль, микроорганизмы, пыльцу растений, некоторые газы, в том числе и те, которые образуют кислотные дожди: оксиды серы, азота и др. Воздух, свободный от переменных и случайных составных частей, прозрачен, лишён цвета, вкуса и запаха, 1 л его при н. у. имеет массу 1,29 г. Молярная масса воздуха объёмом 22,4 л (1 моль) равна 29 г/моль. Воздух — это океан из газов, на дне которого живут люди, животные и растения. Он необходим для дыхания и фотосинтеза. Растворённый в воде кислород воздуха служит для дыхания обитателей водной среды (рыб, водных растений). Велика роль воздуха в процессах выветривания (разрушения) горных пород и для почвообразования (рис. 74). Под действием воздуха и бактерий минерализуются органические остатки — отжившие органические вещества превращаются в минеральные соединения и снова усваиваются растениями.
Из жидкого воздуха получают азот, аргон и кислород, используя разные температуры их кипения (рис. 75). При перегонке сжиженного воздуха первым испаряется азот.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Определите, во сколько раз тяжелее (легче) воздуха кислород, углекислый газ, водород, т. е. определите относительную плотность этих газов по воздуху (D)возд). 2. Зная объёмный состав воздуха, найдите количество вещества каждого газа: азота и кислорода в 100 л воздуха при н. у. 3. Определите число молекул: а) кислорода; б) азота, содержащихся в 22,4 л воздуха при н. у. 4. Вычислите объём воздуха (н. у.), который потребуется для сжигания 20 м3 сероводорода, если при этом образуются вода и оксид серы (IV). Вычислите массу этого воздуха. 5. Подготовьте сообщение о применении кислорода. Что такое озоновые дыры? Как предупредить их появление?
|
|
|