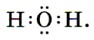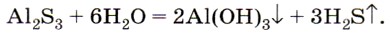|
|
|
|
|
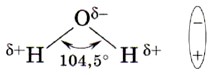
Глава 3. Неметаллы § 20. ВодаСтроение молекулы воды. Давайте вспомним, как построена молекула воды. Она имеет угловое строение: входящие в её состав атомы образуют равнобедренный треугольник, в основании которого находятся два атома водорода, а в вершине — атом кислорода. Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм, угол между связями Н—О—Н равен 104,5°. Из восьми электронов внешнего слоя атома кислорода в молекуле воды четыре электрона задействованы в образовании ковалентных связей О—Н, остальные составляют две непо- делённые электронные пары:
Связи О—Н являются полярными за счёт более высокой электроотрицательности кислорода, на атомах которого возникает частичный отрицательный заряд. На атомах водорода, напротив, возникает частичный положительный заряд:
В целом молекула Н2O является полярной молекулой, т. е. диполем. Водородная химическая связь. Относительная молекулярная масса воды равна 18 и отвечает её простейшей формуле. Почему же это вещество является жидкостью, а, например, хлор, относительная молекулярная масса которого 71, представляет собой при обычных условиях газ? Всё дело в том, что в жидкой воде происходит ассоциация молекул, т. е. соединение их в более сложные агрегаты за счёт особой химической связи, которая называется водородной.
Это очень слабая химическая связь — примерно в 15—20 раз слабее ковалентной. Однако именно благодаря ей некоторые низкомолекулярные вещества (т. е. имеющие небольшую относительную молекулярную массу) имеют повышенные температуры плавления и кипения. Это характерно для воды, спиртов, фторово- дорода, аммиака. Физические свойства воды. Агрегатные состояния воды вам известны из курса начальной школы: жидкое, газообразное и твёрдое (рис. 81). Жидкая вода образует многочисленные реки, ручьи, озёра, Мировой океан. Газообразная вода входит в состав воздуха. Твёрдая вода — это, прежде всего, лёд и снег. Бесконечно многообразен и причудлив узор снежинок. В основе всего многообразия встречающейся в природе воды лежат именно водородные связи. Наличием водородной связи у воды (низкомолекулярного вещества) объясняются и аномально высокие значения её температур плавления (0 °С) и кипения (100 °С). Чистое вещество вода обладает и другими особенностями физических свойств, которые делают это соединение поистине уникальным. Вода способна расширяться при замерзании и имеет максимальную плотность при +4 °С. Поэтому при понижении температуры ниже +4 °С лёд занимает верхнюю часть водоёма, укрывая его нижние слои и защищая водоём от промерзания. Не обладай вода таким свойством, все водоёмы и даже Мировой океан за определённый геологический период промёрзли бы до дна и жизнь на Земле не только не получила бы своего эволюционного развития, она просто бы не возникла на ней.
Вода обладает высокими значениями теплоты плавления и теплоты парообразования, которые академик В. И. Вернадский рассматривал как константы планетарного значения, так как их аномальные значения определяют многие физико-химические и биологические процессы на Земле. Весьма интересно изменяется теплота плавления льда при понижении его температуры. Оказывается, если охладить лёд при нормальном давлении до -7 °С, то количество теплоты, затрачиваемой на его плавление, уменьшается с 333,7 • 103 до 323 • 103 Дж/кг. Таяние льда и снега связано с огромными тепловыми затратами, поэтому процесс происходит постепенно, в большинстве случаев не причиняя вреда природе. На испарение 1 кг воды расходуется 2254 • 103 Дж теплоты, т. е. приблизительно в 7 раз больше, чем на плавление 1 кг льда. В этом причина сохранения воды в жидком состоянии на нашей планете. Даже в самые жаркие дни вода испаряется крайне медленно. Поэтому и сезоны года меняются не резко, а плавно: лето — осень — зима — весна (рис. 82). Вода имеет высокую удельную теплоёмкость. Эта величина показывает, сколько теплоты надо затратить для нагревания 1 кг воды на 1 К (кельвин). Оказывается, на это затрачивается 4,1868 • 103 Дж/(кг • К). Из-за высокой удельной теплоёмкости воды на континентах не бывает резкого перепада температур зимой и летом, ночью и днём, поскольку они окружены гигантским регулятором, своеобразным термостатом — водами Мирового океана.
При нагревании всех веществ их теплоёмкость, как правило, возрастает, однако вода — исключение. Теплоёмкость воды с повышением температуры изменяется аномально: в интервале температур от 0 до 37 °С теплоёмкость падает, а от 37 до 100 °С повышается. Значит, теплоёмкость воды достигает минимального значения при 36—37 °С, т. е. вблизи нормальной температуры тела человека и млекопитающих, благоприятной для биохимических реакций в их организмах. Ещё одна особенность воды — высокое поверхностное натяжение. На каждую молекулу внутри жидкости действуют силы притяжения соседних молекул, окружающих её со всех сторон. Равнодействующая этих сил равна нулю, что не наблюдается для молекул поверхностного слоя. Равнодействующая сил притяжения направлена внутрь жидкости, и поэтому молекулы поверхностного слоя стремятся туда втянуться. Под действием этой силы число молекул на поверхности уменьшается, её площадь сокращается. Но все молекулы, разумеется, не могут уйти вовнутрь. На поверхности остаётся такое их число, при котором она оказывается минимальной. Для перенесения молекул из глубины объёма жидкости в её поверхностный слой необходимо совершить работу по преодолению равнодействующей сил притяжения, которые действуют на молекулу в поверхностном слое.
Поверхностное натяжение собирает воду в капли (рис. 83) и позволяет жуку-водомерке скользить по её поверхности (рис. 84). Оригинальна и ещё одна характеристика воды — её вязкость. Обычно с повышением давления вязкость вещества увеличивается, а с ростом температуры уменьшается. Однако вязкость воды с ростом давления при температуре ниже 30 °С значительно уменьшается. Поэтому активность организмов, живущих в низкотемпературных средах, не сильно зависит от этих температур. Кровь, не потерявшая текучести, продолжает выполнять свои функции столь же интенсивно, как и при более высоких температурах. Вода — главный растворитель не только в живой, но и в неживой природе. По отношению к воде все вещества делятся на два типа.
Гидрофильные вещества хорошо растворимы в воде. К ним относятся многие соли, спирты, кислоты, глюкоза и др. Гидрофобные, плохо растворимые в воде вещества — это жиры, пластмассы, сложные эфиры, жирные кислоты и др.
Химические свойства воды. У автора «Маленького принца» Антуана де Сент-Экзюпери есть очень поэтичные, необыкновенно точные строчки: «Вода! Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое! Нельзя сказать, что ты необходима для жизни: ты — сама жизнь. Ты наполняешь нас радостью, которую не объяснить нашими чувствами... Ты самое большое богатство на свете...» Недаром Экзюпери подчёркивает, что без воды невозможна жизнь на Земле.
Из глюкозы в ходе дальнейших превращений возникает поразительное многообразие органических соединений. Вода — участник практически всех реакций на Земле. Основные химические свойства воды вы уже изучили. Давайте повторим их. Вода взаимодействует с щелочными и щёлочноземельными металлами. (Приведите примеры уравнений реакций, дайте их характеристику и рассмотрите окислительно-восстановительные процессы.) Вода соединяется с основными и кислотными оксидами, если образуется растворимый гидроксид — щёлочь или кислородсодержащая кислота. (Приведите примеры уравнений реакций.) Вода разлагается под действием света, электрического тока или высоких температур (свыше 1500 °С). {Запишите уравнение реакции и рассмотрите окислительно-восстановительные процессы.) Вода разлагает некоторые неорганические и многие органические вещества. Очевидно, некоторые из вас помнят из курса 9 класса, что этот процесс называется гидролизом. Необратимому гидролизу подвергаются некоторые бинарные соединения, например соли летучих бескислородных кислот и нерастворимых оснований:
С обратимым гидролизом солей вы будете знакомиться в старших классах, а с обратимым гидролизом органических соединений вы уже познакомились в курсе биологии. Ведь именно он и составляет основу обмена веществ в живых организмах. {Вспомните, как гидролизуются белки, жиры и углеводы.) Также, очевидно, некоторые из вас помнят из курса 9 класса, что вода образует кристаллогидраты: медный купорос CuSO4 • 5Н2O, кристаллическую соду Na2CO3 • 10Н2О, гипс CaSO4 • 2Н2O.
Вода взаимодействует и с некоторыми неметаллами, например галогенами. С этим свойством воды вы будете знакомиться на следующих уроках.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
1. Какое строение имеет молекула воды? За счёт какой химической связи она образуется? Какие другие типы химических связей вы знаете? 2. Какая связь называется водородной? Как она определяет физические свойства воды? 3. Какие аномалии физических свойств воды вы знаете? Какую роль они играют в природе? 4. Растворение называют физико-химическим процессом. Как растворимость характеризует свойства воды? Как по этому признаку делятся вещества? Для ответа на вопрос обратитесь к таблице растворимости. 5. Какие вещества называются гидрофильными, а какие — гидрофобными? Приведите примеры. 6. Перечислите химические свойства воды, иллюстрируя их уравнениями соответствующих реакций. Какую роль играют эти свойства в природе? 7. В 80 мл воды растворили 80 г медного купороса CuSO4 • 5Н2O. Какой стала массовая доля сульфата меди (II) в полученном растворе? 8. Для наложения гипсовой повязки хирург использовал 290 г алебастра. Какое количество вещества воды было израсходовано в результате превращения алебастра в гипс? Какова масса гипса?
|
|
|