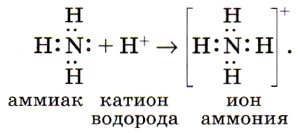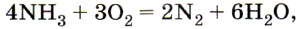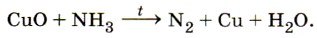|
|
|
|
|
Глава 3. Неметаллы § 29. АммиакПрежде всего рассмотрим строение молекулы аммиака NH3. Как вы уже знаете, на внешнем энергетическом уровне атомы азота содержат пять электронов, из которых три электрона — неспаренные. Именно они и участвуют в формировании трёх ковалентных связей с тремя атомами водорода при образовании молекулы аммиака NH3.
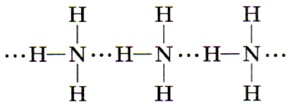
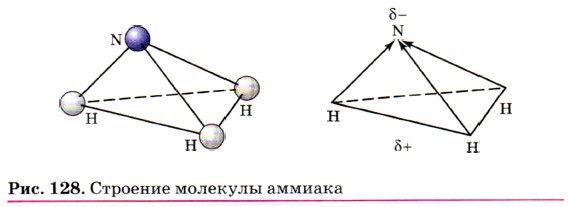
Три общие электронные пары смещены в сторону более электроотрицательного атома азота, а так как молекула аммиака имеет форму треугольной пирамиды (рис. 128), то в результате смещения электронных пар возникает диполь, т. е. молекула с двумя полюсами. Молекулы аммиака (в жидком аммиаке) взаимодействуют, связываясь друг с другом:
Этот особый тип химической межмолекулярной связи, как вы уже знаете, называют водородной связью.
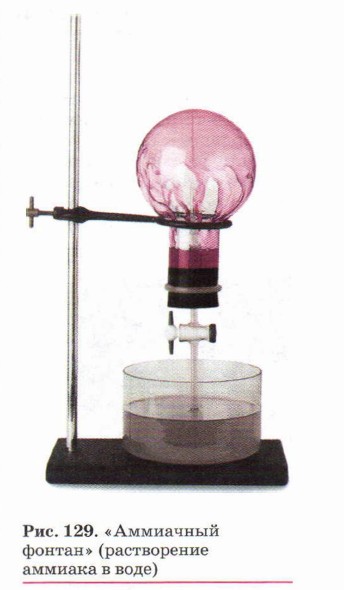
Аммиак — бесцветный газ с резким запахом, почти в два раза легче воздуха. Аммиак нельзя вдыхать продолжительное время, так как он ядовит. Этот газ легко сжижается при обычном давлении и температуре -33,4 °С. При испарении жидкого аммиака из окружающей среды поглощается много тепла, поэтому аммиак применяют в холодильных установках. Аммиак хорошо растворим в воде: при 20 °С в 1 объёме воды растворяется около 710 объёмов аммиака (рис. 129). Концентрированный (25%-й по массе) водный раствор аммиака называют водным аммиаком или аммиачной водой, а используемый в медицине 10%-й раствор аммиака известен под названием нашатырный спирт. В водном растворе аммиака образуется непрочное соединение — гидрат аммиака NH3 • Н2O. Если к раствору аммиака добавить несколько капель фенолфталеина, раствор окрасится в малиновый цвет, что указывает на щелочную среду. Щелочная реакция водных растворов аммиака объясняется наличием гидроксид-ионов ОН-:
Если окрашенный фенолфталеином раствор аммиака подогреть, то окраска исчезнет (почему?).
Аммиак взаимодействует с кислотами, образуя соли аммония. Это взаимодействие можно наблюдать в следующем опыте: стеклянную палочку или стакан, смоченные раствором аммиака, поднести к другой палочке или стакану, смоченным соляной кислотой, — появится густой белый дым (рис. 130):
Вот и верь после этого поговорке, что дыма без огня не бывает.
И водный раствор аммиака, и соли аммония содержат особый ион — катион аммония
При образовании иона аммония донором свободной электронной пары служит атом азота в аммиаке, а акцептором — катион водорода кислоты или воды. Ещё одно химическое свойство аммиака вы сможете сами прогнозировать, если обратите внимание на степень окисления в нём атомов азота, а именно —3. Конечно же аммиак — сильнейший восстановитель, т. е. его атомы азота могут только отдавать электроны, но не принимать их. Так, аммиак способен окисляться или до свободного азота (без участия катализатора):
или до оксида азота (II) (в присутствии катализатора):
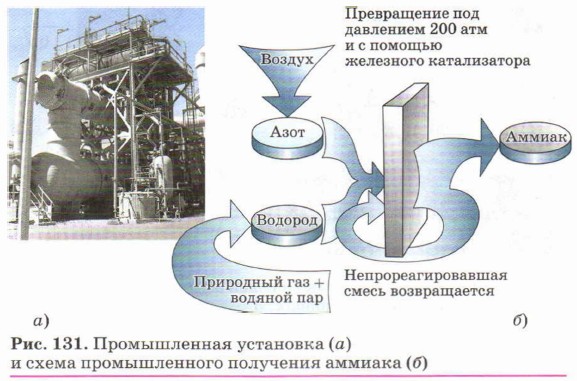
В промышленности аммиак производят синтезом из азота и водорода (рис. 131).
В лаборатории аммиак получают действием гашёной извести Са(ОН)2 на соли аммония, чаще всего на хлорид аммония:
Газ собирают в перевёрнутый кверху дном сосуд, а распознают или по запаху, или по посинению влажной красной лакмусовой бумажки, или по появлению белого дыма при внесении палочки, смоченной соляной кислотой.
Аммиак и его соли широко используют в промышленности и технике, в сельском хозяйстве, быту. Основные области их применения показаны на рисунке 132.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
1. Каково электронное и пространственное строение молекулы аммиака? 2. Перечислите области применения аммиака. Какие свойства аммиака лежат в основе его применения в медицине, холодильных установках? 3. Какую химическую связь называют водородной? В чём особенности водородной связи? Что можно сказать о прочности водородных связей по сравнению с ковалентными и ионными? Какое значение имеет водородная связь в химии и биологии? 4. Приведите примеры веществ, между молекулами которых образуются водородные связи. Как это отражается на физических свойствах этих веществ? 5. На примере образования катиона аммония из молекулы аммиака объясните принцип образования ковалентной связи по донорно-акцепторному механизму. Является ли связь, образованная по донорно-акцепторному механизму, особым типом химической связи? Объясните почему. 6. Как изменится окраска фенолфталеина при добавлении его к нашатырному спирту? Объясните ответ, составив уравнение химической реакции. 7. Какую степень окисления имеет азот: а) в аммиаке; б) в хлориде аммония; в) в нитрате аммония; г) в сульфате аммония? 8. Используя метод электронного баланса, определите коэффициенты в следующей схеме химической реакции:
9. Почему азот в аммиаке проявляет только восстановительные свойства? 10. Как получают аммиак: а) в промышленности; б) в лабораторных условиях?
|
|
|



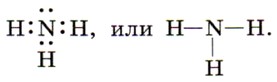
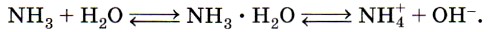


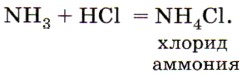
 , играющий роль катиона металла. Ион аммония образуется в результате возникновения ковалентной связи между атомом азота, имеющим свободную (неподелённую) электронную пару, и катионом водорода, который переходит к аммиаку от молекул кислот или воды:
, играющий роль катиона металла. Ион аммония образуется в результате возникновения ковалентной связи между атомом азота, имеющим свободную (неподелённую) электронную пару, и катионом водорода, который переходит к аммиаку от молекул кислот или воды: