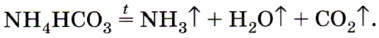|
|
|
|
|
Глава 3. Неметаллы § 30. Соли аммонияКак было сказано, катион аммония Все соли аммония — твёрдые кристаллические вещества, хорошо растворимые в воде. По ряду свойств они похожи на соли щелочных металлов, и в первую очередь на соли калия, так как радиусы ионов К+ и
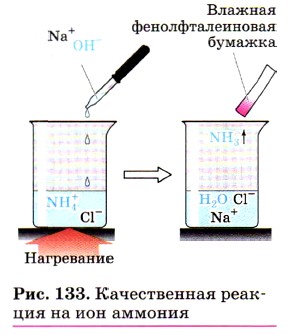
Соли аммония получают взаимодействием аммиака или его водного раствора с кислотами. Они обладают всеми свойствами солей, обусловленными наличием кислотных остатков. Например, хлорид или сульфат аммония реагируют соответственно с нитратом серебра или хлоридом бария, образуя при этом характерные осадки. Карбонат аммония взаимодействует с кислотами, так как в результате реакции образуется углекислый газ. Кроме того, ион аммония обусловливает другое, общее для всех солей аммония свойство: его соли реагируют с щелочами при нагревании с выделением аммиака (рис. 133), например:
или в ионном виде:
Эта реакция является качественной реакцией на соли аммония, так как образующийся аммиак легко обнаружить (какими способами это можно сделать?).
Третья группа свойств солей аммония — это их способность разлагаться при нагревании с выделением газообразного аммиака, например:
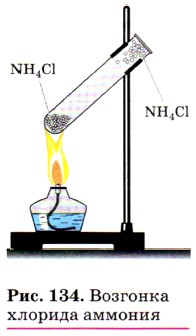
В этой реакции образуется также газообразный хлороводород, который улетучивается вместе с аммиаком, а при охлаждении вновь соединяется с ним, образуя соль, т. е. при нагревании в пробирке сухой хлорид аммония как бы возгоняется, но на холодных стенках верхней части пробирки снова оседает в виде белых кристалликов NH4Cl (рис. 134). Основные области применения солей аммония были показаны ранее (см. рис. 132). Здесь обратим ваше внимание на то, что почти все соли аммония используют в качестве азотных удобрений. Как вы знаете, растения способны усваивать азот только в связанном виде, т. е. в виде ионов Отметим другие области применения некоторых солей аммония. Хлорид аммония NH4Cl используют при паянии, так как он очищает поверхность металла от оксидной плёнки и к ней хорошо пристаёт припой. Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 применяют в изготовлении кондитерских изделий, так как эти соединения легко разлагаются при нагревании и образуют газы, разрыхляющие тесто и делающие его пышным:
Нитрат аммония NH4NO3 в смеси с порошками алюминия и угля используют в качестве взрывчатого вещества — аммонала, который широко применяют при разработке горных пород.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
1. Напишите уравнения реакций (в молекулярной и ионной формах) между растворами веществ: а) сульфат аммония и хлорид бария; б) хлорид аммония и нитрат серебра. 2. Напишите уравнения реакций, характеризующих свойства карбоната аммония: взаимодействия с кислотой, щёлочью, солью; реакции разложения. Первые три уравнения запишите также в ионной форме. 3. С многоосновными кислотами аммиак образует не только средние, но и кислые соли. Напишите формулы кислых солей, которые он может дать при взаимодействии с фосфорной кислотой. Назовите их и напишите уравнения диссоциации этих солей. 4. Составьте молекулярные и, где это возможно, ионные уравнения реакций, с помощью которых можно осуществить следующие переходы:
5. Определите количество вещества, объём (н. у.) и массу аммиака, необходимого для получения 250 кг сульфата аммония, используемого в качестве удобрения.
|
|
|



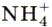 играет роль катиона металла и образует с кислотными остатками соли: NH4NO3 — нитрат аммония, или аммиачная селитра, (NH4)2SO4 — сульфат аммония и т. д.
играет роль катиона металла и образует с кислотными остатками соли: NH4NO3 — нитрат аммония, или аммиачная селитра, (NH4)2SO4 — сульфат аммония и т. д.
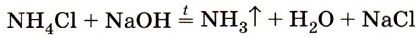
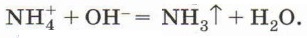

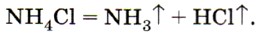
 или
или  . Замечательный русский агрохимик Д. Н. Прянишников выяснил, что если у растения есть выбор, то оно предпочитает катион аммония нитрат- аниону, поэтому использование солей аммония в качестве азотных удобрений особенно эффективно. Очень ценным азотным удобрением является нитрат аммония NH4NO3.
. Замечательный русский агрохимик Д. Н. Прянишников выяснил, что если у растения есть выбор, то оно предпочитает катион аммония нитрат- аниону, поэтому использование солей аммония в качестве азотных удобрений особенно эффективно. Очень ценным азотным удобрением является нитрат аммония NH4NO3.