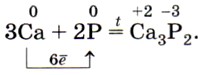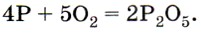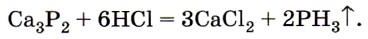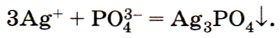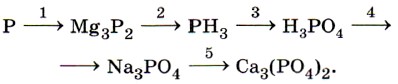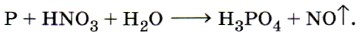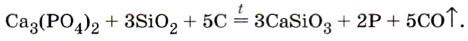|
|
|
|
|
Глава 3. Неметаллы § 32. Фосфор и его соединения
Строение и свойства атомов. Следующий после азота представитель главной подгруппы V группы Периодической системы Д. И. Менделеева — элемент-неметалл фосфор Р. Атомы фосфора по сравнению с атомами азота имеют больший радиус, меньшее значение электроотрицательности, а значит, более выраженные восстановительные свойства. Соединения со степенью окисления -3 атома фосфора встречаются реже, чем у азота (только в фосфидах — соединениях фосфора с металлами, например Са3Р2, Na3P). Чаще фосфор проявляет в соединениях степень окисления 4-5. А в его соединении с водородом — фосфине РН3 — ковалентная связь между атомами разных элементов малополярна в силу того, что значения электроотрицательности фосфора и водорода почти одинаковы. Фосфор — простое вещество. Химический элемент фосфор образует несколько аллотропных модификаций. Вы уже знаете два простых вещества: белый фосфор и красный фосфор. Белый фосфор (рис. 137, а) имеет молекулярную кристаллическую решётку, состоящую из молекул Р4.
Он нерастворим в воде, но хорошо растворяется в сероуглероде. На воздухе белый фосфор легко окисляется, а в порошкообразном состоянии даже воспламеняется.
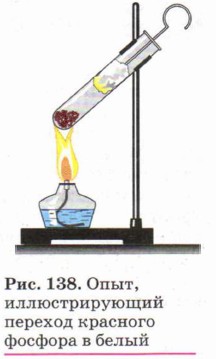
Белый фосфор очень ядовит. Особым его свойством является способность светиться в темноте вследствие его окисления. Хранят его под водой. Красный фосфор (рис. 137, б) представляет собой тёмно-малиновый порошок. Он не растворяется ни в воде, ни в сероуглероде. На воздухе окисляется медленно и не самовоспламеняется. Неядовит и не светится в темноте. При нагревании красного фосфора в пробирке (рис. 138), закрытой ватным тампоном, он превращается в белый фосфор. Если выдернуть тампон, то осевший на нём белый фосфор вспыхнет на воздухе. Этот опыт показывает огнеопасность белого фосфора. Химические свойства красного и белого фосфора близки, но белый фосфор более химически активен. Так, оба они, как и положено неметаллам, взаимодействуют с металлами, образуя фосфиды:
Белый фосфор самовоспламеняется на воздухе, а красный горит при поджигании. В обоих случаях образуется оксид фосфора (V), выделяющийся в виде густого белого дыма:
С водородом фосфор непосредственно не реагирует, поэтому фосфин РН3 можно получить только косвенным путём, например из фосфидов:
Фосфин — это очень ядовитый газ с неприятным запахом. Легко воспламеняется на воздухе. Это свойство фосфина и объясняет появление болотных блуждающих огней. Соединения фосфора. При горении фосфора образуется, как вы уже знаете, оксид фосфора (V) Р2O5 — белый гигроскопичный порошок. Это типичный кислотный оксид, обладающий всеми свойствами кислотных оксидов (вспомните какими). Оксиду фосфора (V) соответствует фосфорная кислота Н3РO4. Она представляет собой твёрдое прозрачное кристаллическое вещество, хорошо растворимое в воде в любых соотношениях. Как трёхосновная кислота, Н3РO4 образует три ряда солей:
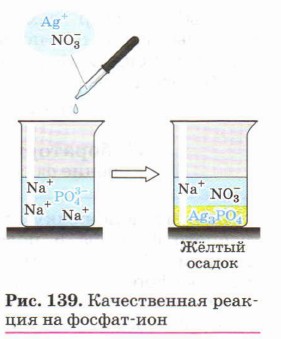
Реактивом на растворимые фосфаты является раствор нитрата серебра, при взаимодействии с которым образуется жёлтый осадок Ag3PO4 (рис. 139):
Однако в отличие от AgBr и Agl этот осадок растворяется при добавлении раствора кислоты {почему?).
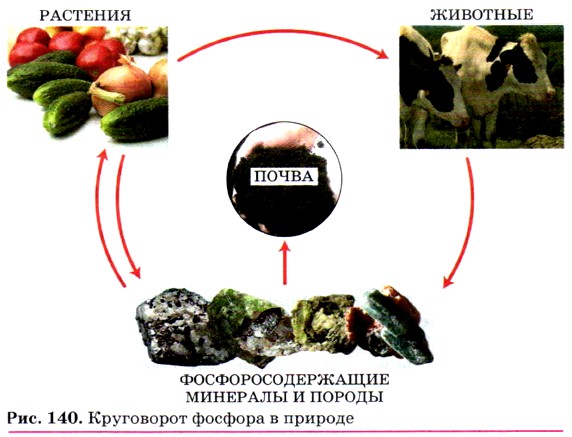
В природе фосфор в свободном виде не встречается — только в виде соединений. Важнейшими природными соединениями фосфора являются минералы фосфориты и апатиты. Основную их массу составляет фосфат кальция Са3(РO4)2, из которого и получают в промышленности фосфор. Биологическое значение фосфора. Фосфор является составной частью тканей организмов человека, животных и растений. В организме человека большая часть фосфора связана с кальцием. Для построения скелета ребёнку требуются одинаковые количества фосфора и кальция. Кроме костей, фосфор содержится в нервной ткани, крови, молоке. В растениях фосфор входит в состав белков. Из фосфора, поступающего в организм человека с пищей, главным образом с яйцами, мясом, молоком и хлебом, строится АТФ — аденозинтрифосфорная кислота, которая служит основным источником энергии для внутриклеточных процессов, а также нуклеиновые кислоты — ДНК и РНК, осуществляющие передачу наследственных свойств организма. Наиболее интенсивно АТФ расходуется в активно работающих органах тела: печени, мышцах, мозге. Недаром знаменитый минералог, один из основоположников науки геохимии, академик А. Е. Ферсман назвал фосфор «элементом жизни и мысли ». Как было указано, фосфор существует в природе в виде соединений, содержащихся в почве (или растворённых в природных водах). Из почвы фосфор извлекается растениями, а животные получают его с растительной пищей. После отмирания растительных и животных организмов фосфор снова переходит в почву. Так осуществляется круговорот фосфора в природе (рис. 140). Применение фосфора и его соединений. Красный фосфор используют для производства спичек, фосфорной кислоты, которая, в свою очередь, идёт на производство фосфорных удобрений и кормовых добавок для животноводства. Кроме того, фосфор применяют для получения ядохимикатов (вспомните баллончики с дихлофосом, хлорофосом и др.) (рис. 141). Открытие фосфора. Фосфор открыт немецким алхимиком Г. Брандом в 1669 г., а своё название получил за способность светиться в темноте (в пер. с греч. фосфор — светоносный).
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
1. Напишите формулы трёх видов солей натрия и фосфорной кислоты, назовите их и запишите уравнения их диссоциации. 2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Рассмотрите окислительно-восстановительные процессы там, где они имеют место. 3. Используя метод электронного баланса, составьте уравнение реакции, протекающей по схеме:
4. В промышленности фосфор получают прокаливанием смеси фосфата кальция с песком и коксом согласно уравнению:
Рассмотрите окислительно-восстановительные процессы. Придумайте и решите задачу на определение массы фосфора при известном выходе его от теоретически возможного, в условии задачи укажите массу исходного фосфата кальция и долю примесей в нём. 5. Сколько килограммов 80%-й фосфорной кислоты можно получить из 31 кг фосфора, содержащего 5% примесей? 6. В 980 г 5%-го раствора фосфорной кислоты растворили 152 г оксида фосфора (V). Вычислите массовую долю фосфорной кислоты в полученном растворе. 7. «...Да! Это была собака, огромная, чёрная, как смоль. Но такой собаки ещё никто из нас, смертных, не видывал. Из её отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку мерцал переливающийся огонь. Ни в чьём воспалённом мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана... Страшный пёс, величиной с молодую львицу. Его огромная пасть всё ещё светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. — Фосфор, — сказал я». В этом отрывке из повести «Собака Баскервилей» А. Конан Дойл допустил существенную химическую ошибку. Назовите её.
|
|
|