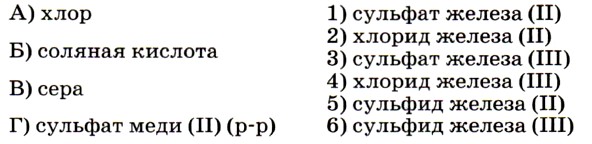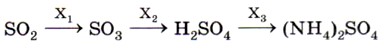|
|
|
|
|
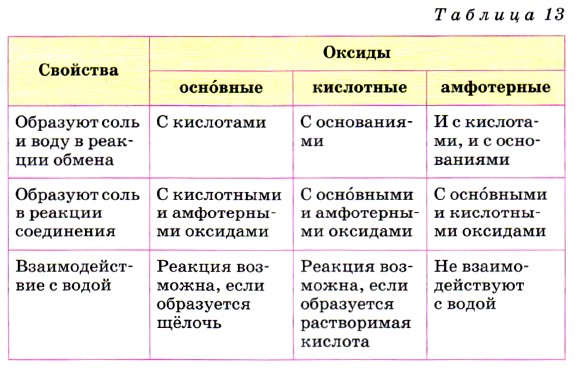
Глава 4. Обобщение знаний по химии за курс основной школы. Подготовка к ГИА § 42. Характерные химические свойства неорганических веществХарактерные химические свойства солеобразующих оксидов
Характерные химические свойства оснований и амфотерных гидроксидов1. а) Основание (или амфотерный гидроксид) + кислота = соль + вода.
2. Основание + кислотный оксид = соль + вода. 3. Щёлочь + растворимая соль = новая соль + новое основание (если образуется осадок или газ). 4. Щёлочь + амфотерный гидроксид = соль + вода. 5. Нерастворимое основание (или амфотерный гидроксид) Характерные химические свойства кислот1. Кислота + металл = соль + водород (если: Примечания. 1) Щелочные металлы для реакций с растворами кислот не берут, так как они взаимодействуют в первую очередь с водой. 2) Азотная кислота любой концентрации и концентрированная серная кислота взаимодействуют с простыми веществами по-особому. 2. Кислота + оксид металла (основный или амфотерный) = соль + вода. 3. Кислота + основание (гидроксид или бескислородное основание) = соль + вода (для бескислородных оснований — только соль). 4. Кислота + соль = новая кислота + новая соль (если образуется осадок или газ). Характерные химические свойства солей1. Соль + кислота = новая кислота + новая соль (если образуется осадок или газ).
4. Соль (раствор) + металл = новая соль + новый металл (если: Примечание. Щелочные металлы для реакций с растворами солей не берут, так как они взаимодействуют в первую очередь с водой. Примеры тестовых заданий и рекомендации к их выполнению1. Соль и водород образуются при взаимодействии разбавленной серной кислоты с каждым из металлов ряда 1) А1, Zn, Си 3) Mg, Zn, Fe
Разбавленная серная кислота проявляет характерные свойства кислот, а потому не будет реагировать с металлами, стоящими в ряду напряжений после водорода, что автоматически исключает ответы 1 и 4. Варианты 2 и 3 предлагают металлы, стоящие в ряду напряжений до водорода. Какой выбрать? Очевидно, следует исключить из числа вероятных ответ 2, так как он содержит свинец, а сульфат свинца (II)— практически нерастворимая соль, о чём свидетельствует соответствующая клеточка в таблице растворимости. Ответ: 3. 2. При термическом разложении нерастворимых оснований образуются 1) оксид неметалла и вода
Как неверные, должны быть исключены ответы 1,2 и 4. Ответ: 3. 3. С раствором хлорида меди (II) не реагирует 1)Мg 2) Zn 3) Fe 4) Ag Лёгкое задание на знание ряда напряжений металлов. Ответ: 4. 4. Основание образуется при взаимодействии с водой оксида, формула которого 1) Fe2O3 2) CuO 3) CaO 4) FeO В основе поиска верного ответа лежит знание о том, что оксиды металлов взаимодействуют с водой лишь в случае образования растворимого гидроксида — щёлочи. Следовательно, это должен быть оксид щелочного или щёлочноземельного металла. Ответ: 3. 5. С гидроксидом бария реагирует каждое из веществ, формулы которых 1) NaCl, Na2SO4, Na2CO3 3) ZnO, K2O, CO2
Так как Ba(OH)2 — щёлочь, то знание свойств растворимых оснований и особенностей протекания реакций с их участием позволит определить верный ответ — 4. К такому же результату можно прийти, исключив варианты 2 (он включает щёлочь) и 3 (он, кроме амфотерного и кислотного, включает основный оксид). Остаются варианты 1 и 4. Все соединения первого варианта — соли, но если две последние соли образуют осадок с гидроксидом бария, то первая — нет. Ответ: 4. 6. В цепочке превращений S → X1 → SO3 → Х2 → CuSO4 → Х3 → CuO → Сu веществами Х1, Х2 и Х3 являются соответственно 1) H2S, H2SO4, Cu(OH)2 3) SO2, H2SO4, CuCl2
Ответы 1 и 2 следует отбросить, так как при окислении сероводорода и сульфида железа (II) образуется не SO3, a SO2. В варианте 3 первые два искомых вещества указаны верно, a CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию невозможно. Ответ: 4. 7. Установите соответствие между веществом, реагирующим с железом (левый столбец), и названием железосодержащего продукта, который при этом образуется (правый столбец).
Задание выполнить несложно, так как из числа приведённых в условии реагентов только сильный окислитель — хлор окисляет железо до степени окисления +3 (соответствие А — 4). Остальные реагенты окисляют его до степени окисления +2. Ответ: 4251. 8. Установите соответствие между названием вещества (левый столбец) и названием продукта его горения (правый столбец).
Знание химических свойств простых веществ, указанных в левом столбце, позволит легко установить верные соответствия. Ответ: 635. 9. Установите соответствие между исходными веществами (левый столбец) и продуктами их взаимодействия (правый столбец).
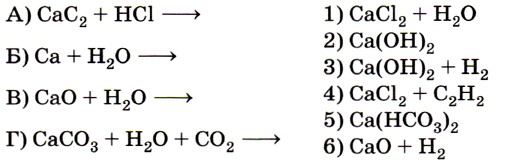
Вначале исключается заведомо неверный вариант 6 (в водной среде образование оксида кальция невозможно). Очевидно, необходимо исключить и вариант 1, так как для него нет соответствующей левой части уравнения. Некоторые сложности может вызвать соответствие Г — 5, основанное на знании перехода карбоната в гидрокарбонат и обратно. Ответ: 4325. 10. Установите соответствие между названием оксида (левый столбец) и формулами веществ, с которыми он взаимодействует (правый столбец).
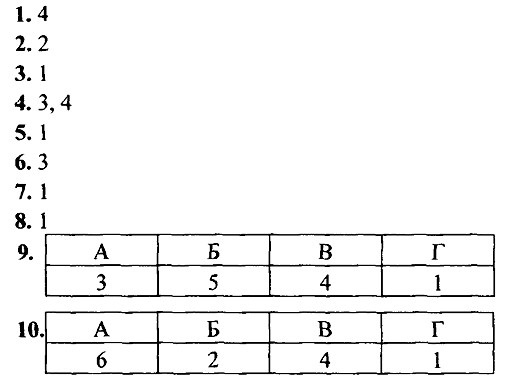
В соответствии с рекомендациями для задания 1 для оксида хрома (В) исключаются варианты 1, 2, 4, 6 и устанавливается соответствие с 5 (как амфотерный оксид, Сr2O3 взаимодействует с щелочами, а также восстанавливается алюминием). Оксид калия, как основный, взаимодействует с веществами группы 4. Несолеобразующий оксид углерода (II) является восстановителем и вступает в реакции с веществами группы 3: взаимодействием СО с Н2 получают метанол, восстанавливают железо из оксидов (чёрная металлургия) и используют как газообразное топливо (генераторный газ). Кислотный оксид азота (V) взаимодействует с веществами группы 1. Ответ: 4351. Задания для самостоятельной работы1.Водород можно получить при взаимодействии 1) меди с разбавленной азотной кислотой
2. При термическом разложении нитрата серебра образуются 1) оксид серебра и оксид азота (V)
3. С раствором щёлочи не реагирует 1)Mg 2) Zn 3) Аl 4) Be 4. С раствором сульфата меди (II) взаимодействует 1)Рb 2) Hg 3) Fe 4) Ag 5. Взаимодействием соответствующего оксида с водой нельзя получить 1) Си(ОН)2 2) Ва(ОН)2 3) H2SO4 4) NaOH 6. Медь из раствора сульфата меди (II) вытесняет каждый из металлов ряда 1) Na, Cr, Zn 3) Fe, Zn, Аl
7. И с соляной кислотой, и с водой реагирует 1) аммиак 3) никель
8. В схеме превращений
веществами Х4, Х2 и Х3 являются соответственно 1) O2, Н2O, NH3 3)O2, Н2O, N2
9. Установите соответствие между названием оксида (левый столбец) и формулами веществ, с которыми он может взаимодействовать (правый столбец).
10. Установите соответствие между названием соли (левый столбец) и формулами веществ, с которыми она может взаимодействовать в водном растворе (правый столбец).
Характерные химические свойства неорганических веществ. Ответы
|
|
|



 оксид металла + вода.
оксид металла + вода.