|
|
|
|
|
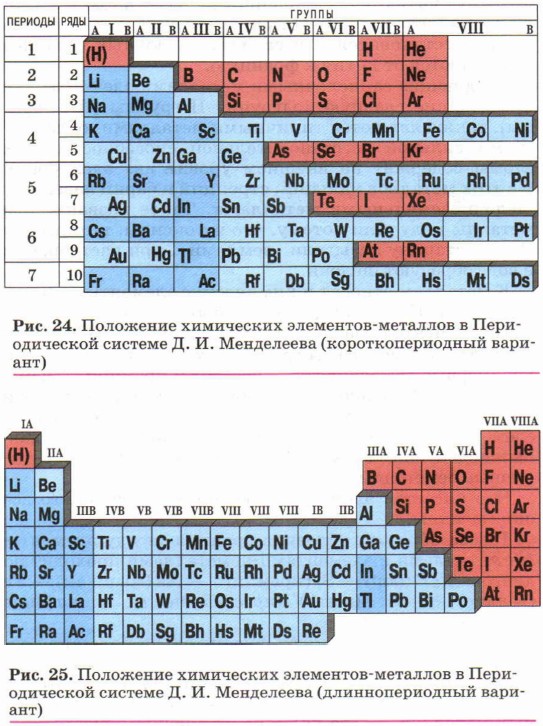
Глава 2. Металлы § 8. Положение металлов в Периодической системе Д. И. Менделеева и строение их атомовКак вам уже известно из курса химии 9 класса, большинство химических элементов относят к металлам (рис. 24 и 25). В Периодической системе Д. И. Менделеева каждый период, кроме первого (он включает в себя два элемента-неметалла — водород и гелий), начинается с активного химического элемента-металла. Эти элементы образуют главную подгруппу I группы (IA группу) и называются щелочными металлами. Своё название они получили от названия соответствующих им гидроксидов, хорошо растворимых в воде, — щелочей.
Атомы щелочных металлов содержат на внешнем энергетическом уровне только один электрон, который они легко отдают при химических взаимодействиях, поэтому являются сильнейшими восстановителями. Понятно, что в соответствии с увеличением радиуса атома восстановительные свойства щелочных металлов усиливаются от лития к францию. Следующие за щелочными металлами элементы, составляющие главную подгруппу II группы (НА группы), также являются типичными металлами, обладающими сильной восстановительной способностью (их атомы содержат на внешнем уровне два электрона). Из этих металлов кальций, стронций и барий называют щёлочноземельными металлами. Такое название эти металлы получили потому, что их оксиды, которые на Руси в старину называли «землями», при растворении в воде образуют щёлочи. К металлам относят и химические элементы главной подгруппы III группы (ША группы), исключая бор. Из элементов главных подгрупп следующих групп к металлам относят: в IVA группе — германий1, олово, свинец (первые два элемента — углерод и кремний — неметаллы), в VA группе — сурьму и висмут (первые три элемента — неметаллы), в VIA группе только последний элемент — полоний — явно выраженный металл. В главных подгруппах VIIA и VIIIA групп все элементы — типичные неметаллы. 1 Германий проявляет и некоторые неметаллические свойства, занимая промежуточное положение между металлами и неметаллами. Что касается элементов побочных подгрупп, то все они металлы. Таким образом, условная граница между элементами-металлами и элементами-неметаллами проходит по диагонали В (бор) — Si (кремний) — As (мышьяк) — Те (теллур) — At (астат) (проследите её в таблице Д. И. Менделеева). Атомы металлов имеют сравнительно большие размеры (радиусы), поэтому их внешние электроны значительно удалены от ядра и слабо с ним связаны. Вторая особенность, которая присуща атомам наиболее активных металлов, — это наличие на внешнем энергетическом уровне 1—3 электронов. Отсюда вытекает самое характерное химическое свойство всех металлов — их восстановительная способность, т. е. способность атомов легко отдавать внешние электроны, превращаясь в положительные ионы. Металлы — свободные атомы и простые вещества — не могут быть окислителями, т. е. атомы металлов не могут присоединять к себе электроны. Следует, однако, иметь в виду, что деление химических элементов на металлы и неметаллы условно. Вспомните, например, свойства аллотропных модификаций олова: серое олово, или α-олово, — неметалл, а белое олово, или β-олово, — металл. Другой пример — модификации углерода: алмаз — неметалл, а графит имеет некоторые характерные свойства металла, например электропроводность. Хром, цинк и алюминий — типичные металлы, но образуют оксиды и гидроксиды амфотерного характера. И наоборот, теллур и иод — типичные неметаллы, но образованные ими простые вещества обладают некоторыми свойствами, присущими металлам.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Какие особенности строения атомов металлов определяют их восстановительные свойства? 2. Назовите химический элемент, образующий простое вещество — самый активный металл. Обоснуйте свой выбор. 3. Как согласуется утверждение о том, что металлы проявляют только восстановительные свойства и, следовательно, при этом окисляются, с процессом, который можно отразить с помощью уравнения
|
|
|





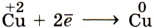 ? Назовите этот процесс.
В каких формах существования химического элемента выступает медь? Для какой формы существования химических элементов справедливо указанное выше утверждение?
? Назовите этот процесс.
В каких формах существования химического элемента выступает медь? Для какой формы существования химических элементов справедливо указанное выше утверждение?