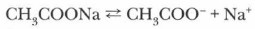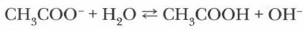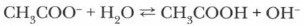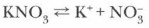|
|
|
|
|
Дополнительный материал к § 11 Гидролиз солейЕсли в три пробирки налить по 2-3 мл растворов солей, например хлорида алюминия, ацетата натрия, нитрата калия, и добавить в каждую пробирку по 2-3 капли раствора лакмуса, то можно наблюдать разные изменения окраски индикатора. Проблема. Все исследуемые в опыте вещества — растворы солей, сильных электролитов. Почему же в разных растворах окраска лакмуса изменилась неодинаково? Начнем анализировать результаты опыта с раствора ацетата натрия, в котором лакмус стал синим. При растворении соль диссоциировала:
Катионы натрия и ацетат-ионы находятся в растворе, где наряду с молекулами воды присутствуют и ее ионы, которые в незначительных количествах образуются при диссоциации этого слабого электролита. Противоположно заряженные ионы притягиваются друг к другу, при столкновениях они могут ассоциироваться. Однако гидроксид натрия — сильный электролит, поэтому образовавшиеся ионные пары будут вновь диссоциировать. А вот ацетат-ионы, соединяясь с ионами Н+, образуют молекулы слабого электролита — уксусной кислоты, константа диссоциации которой очень невелика (К = 2 • 10-5). Связывание ацетат-ионами протонов ведет к накоплению в растворе гидроксид-ионов, что и объясняет наличие щелочной среды и изменение окраски лакмуса в растворе ацетата натрия на синюю:
Описанное явление называется гидролизом. Гидролиз («разложение водой») охватывает большой круг явлений, распространенных в природе и имеющих большое практическое значение. Существует даже целая отрасль народного хозяйства — гидролизная промышленность, занимающаяся производством ценных продуктов (глюкозы, белковых дрожжей) из непищевого сырья — древесных опилок, соломы, кукурузных кочерыжек и т. п. Мы пока познакомимся лишь с одним частным случаем, а именно с гидролизом солей. Разобранный выше пример позволяет сформулировать определение.
Уравнение гидролиза ацетата натрия можно записать следующим образом:
Из определения ясно, что для предсказания возможности протекания гидролиза необходимо анализировать состав соли с целью выяснения вопроса: какие электролиты (сильные или слабые) могут быть образованы ее ионами в процессе обменного взаимодействия с водой? Отсюда становится понятным сохранение фиолетовой окраски лакмуса в растворе нитрата калия. При диссоциации этой соли:
образуются ионы, не способные в растворе связывать ионы водорода или гидроксид- ионы, поскольку в результате ассоциации образовались бы молекулы сильных электролитов — гидроксида калия и азотной кислоты, которые тут же диссоциируют вновь. Покраснение лакмуса в растворе соли алюминия объясняется тем, что катионы алюминия в водном растворе взаимодействуют с водой, связывая гидроксид-ионы. Накопление ионов водорода определяет кислую реакцию среды, в которой лакмус становится красным. Поскольку катион алюминия трехзаряден, гидролиз может протекать по ступеням. Первая ступень гидролиза:
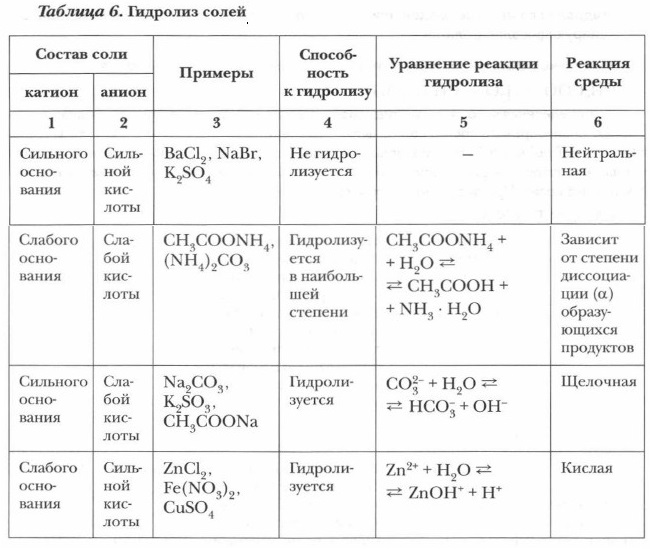
При прохождении гидролиза по первым двум ступеням происходит столь значительное накопление ионов водорода (гидроксония Н3O+), что в соответствии с принципом Ле Шателье равновесие смещается влево, и по третьей ступени гидролиз уже не протекает. При обычных условиях гидролиз в наибольшей степени идет по первой ступени, поэтому мы ограничимся написанием уравнений гидролиза по первой ступени. По способности к гидролизу все соли на основе их состава могут быть разделены на четыре группы (табл. 6).
|
|
|