|
|
|
|
|
Глава 3. Общая характеристика неметаллов § 12. Элементы-неметаллы в периодической системе Д.И. Менделеева и в природеВ процессе изучения химии вы уже ознакомились со многими неметаллическими элементами и их соединениями. Наиболее известные вам неметаллы — водород, кислород и их уникальное соединение — вода. В 8 классе на примере VII группы главной подгруппы периодической системы вы ознакомились с семейством неметаллических элементов — галогенами, с их свойствами. В этом разделе вы получите целостные представления об элементах-неметаллах. Учитывая, что вы имеете некоторый запас знаний о них, умеете использовать периодическую систему Д.И. Менделеева, мы изменим привычный порядок изложения и пойдем в изучении неметаллов не от частного к общему, а, наоборот, от их общих свойств к ознакомлению с их группами, а затем и с конкретными представителями групп неметаллов. Такой подход называют дедуктивным.
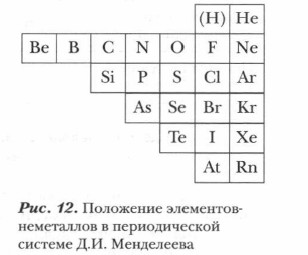
Рассмотрим положение элементов-неметаллов в периодической системе. Уточним вначале их место в периодах. Элементы-неметаллы находятся в правом верхнем углу периодической системы, занимая большую часть малых периодов и размещаясь в конце нечетных рядов больших периодов. С увеличением порядковых номеров неметаллические свойства этих элементов усиливаются. Причину следует искать в изменении электронных структур их атомов: с увеличением порядкового номера их внешний электронный слой последовательно увеличивается на один p-электрон, от p1 до p6, за исключением элементов первого периода Н— Не, у которых электроны заполняют лишь ls-орбиталь (табл. 9).
Итак, элементы-неметаллы расположены в IIIA-VIIIA-группах периодической системы. Вместе с тем не все A-группы периодической системы состоят из элементов-неметаллов. Их число в главной подгруппе возрастает с увеличением ее номера. Так, в IIIA-группе находится только один элемент-неметалл (бор), в IVA-группе их два (углерод и кремний), в VA-группе — три элемента и т. д. В VIIA-группе уже все элементы — неметаллы. Это известные вам галогены. VTIIA-группу занимают благородные газы. Их также относят к неметаллам. Проведенный анализ положения элементов-неметаллов в периодической системе Д.И. Менделеева позволяет сделать следующие выводы.
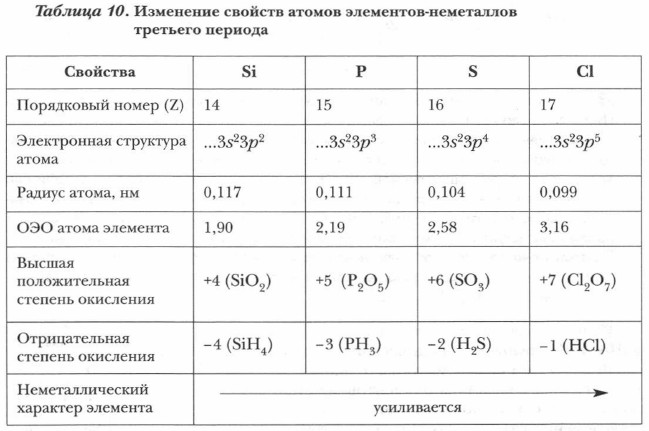
Рассмотрим периодическое изменение некоторых свойств элементов-неметаллов на примере третьего периода (табл. 10).
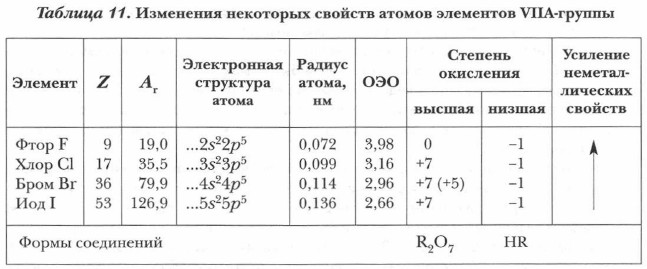
Для этих элементов характерны газообразные водородные соединения и высшие кислородные соединения кислотного характера. Формы и свойства водородных и высших кислородных соединений зависят от характерных степеней окисления данного элемента. Анализ свойств элементов-неметаллов по их положению в главных подгруппах. У всех элементов-неметаллов одной A-группы одинаковое число внешних электронов при разном количестве электронных слоев в атомах. Число электронов внешнего слоя у атомов элементов одной A-группы равно номеру группы, в которой они располагаются. Их числу соответствует и высшая степень окисления элемента в кислородных соединениях, а также форма последних. Рассмотрим закономерности изменения некоторых свойств элементов- неметаллов на примере уже изученной вами подгруппы галогенов (табл. 11).
|
|
|



 По каким признакам можно разделить все химические элементы?
По каким признакам можно разделить все химические элементы?
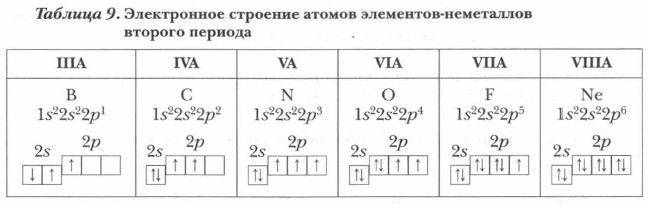
 Обратите внимание, что у атомов первых элементов-неметаллов второго периода (В, С, N) число неспаренных p-электронов нарастает, достигая максимума у азота, а затем уменьшается. У неона, завершающего второй период, все электроны внешнего слоя (валентные электроны) спарены. Подобное строение имеют и другие атомы элементов, завершающих периоды (Ar, Кr, Хе, Rn), у которых все S- и р-орбитали внешнего слоя заняты спаренными электронами, образующими устойчивую восьмиэлектронную структуру ns2np6. При обычных условиях их простые вещества, как правило, не вступают в химические реакции и представляют собой одноатомные газы. Поэтому их часто называют инертными газами или благородными газами. Последнее название более целесообразно, так как известны некоторые соединения этих элементов (например, XeO4, RnF6 и др.).
Обратите внимание, что у атомов первых элементов-неметаллов второго периода (В, С, N) число неспаренных p-электронов нарастает, достигая максимума у азота, а затем уменьшается. У неона, завершающего второй период, все электроны внешнего слоя (валентные электроны) спарены. Подобное строение имеют и другие атомы элементов, завершающих периоды (Ar, Кr, Хе, Rn), у которых все S- и р-орбитали внешнего слоя заняты спаренными электронами, образующими устойчивую восьмиэлектронную структуру ns2np6. При обычных условиях их простые вещества, как правило, не вступают в химические реакции и представляют собой одноатомные газы. Поэтому их часто называют инертными газами или благородными газами. Последнее название более целесообразно, так как известны некоторые соединения этих элементов (например, XeO4, RnF6 и др.).