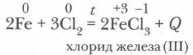|
|
|
|
|
Глава 3. Общая характеристика неметаллов § 13. Простые вещества-неметаллы, их состав, строение, общие свойства и способы получения
Состав и агрегатное состояние неметаллов. Вы уже знакомы со многими простыми веществами-неметаллами: кислородом, водородом, галогенами. Это вещества, в молекулах которых атомы одного и того же химического элемента связаны между собой ковалентной неполярной связью. С помощью этой связи образуются разные по составу и строению простые вещества-неметаллы. Одни из них в обычных условиях существуют в виде двухатомных молекул (Н2, Сl2, O2, N2 и др.), другие образуют более сложные по составу молекулы (так, у фосфора они состоят из четырех атомов, а у ромбической серы — из восьми и т. д.), а также есть простые вещества, представляющие собой атомные агрегаты (кремний, углерод в виде алмаза и графита и др.). В обычных условиях неметаллы существуют в различных агрегатных состояниях: в виде газов, состоящих из одноатомных (инертные газы), двухатомных (кислород, водород, фтор, хлор, азот и др.), трехатомных молекул (озон), и в виде жидкости — бром; в виде твердых кристаллических и аморфных веществ (кремний, углерод и др.). Строение твердых неметаллов также различно: одни имеют молекулярное, другие немолекулярное строение. Многие простые вещества-неметаллы в твердом состоянии имеют молекулярный тип кристаллической решетки. Из известных вам неметаллов углерод и кремний имеют атомный тип кристаллической решетки, в которой атомы связаны между собой прочной ковалентной связью, имеющей высокую энергию, например алмаз. Поэтому вещества с атомной кристаллической решеткой имеют высокие температуры плавления и кипения. Для молекулярных веществ характерен молекулярный тип кристаллической решетки, где связь между составляющими ее частицами (молекулами) осуществляется сравнительно слабыми межмолекулярными взаимодействиями, которые обусловливают их некоторые физические свойства: малую прочность, сравнительно низкую температуру плавления и кипения, а следовательно, и высокую летучесть. Молекулярные вещества находятся при обычных условиях в газообразном (кислород, азот и др.) и твердом состоянии (фосфор, сера и др.). Вспомните свойства кристаллического иода.
Некоторые неметаллы в твердом виде существуют не только в кристаллическом, но и в аморфном состоянии. Аморфные вещества представляют собой агрегаты частиц, расположенных более беспорядочно, чем в кристалле. В отличие от кристаллических веществ, имеющих определенную температуру плавления и кипения, аморфные вещества плавятся в интервале температур. В зависимости от условий, при которых происходит переход из расплавленного состояния в твердое, одно и то же вещество можно получить как в кристаллическом, так и в аморфном виде. Так, например, при прокаливании диоксида кремния SiO2 с магнием можно получить бурый порошок аморфного кремния. Вещества в аморфном состоянии отличает более высокая химическая активность по сравнению с веществами в кристаллическом состоянии. Задание. Приведите примеры простых веществ, образованных атомами одного и того же химического элемента. Некоторые неметаллы способны существовать в виде нескольких простых веществ. Примером может служить элемент углерод и его простые вещества: алмаз, графит и др. Способность атомов одного и того же элемента образовывать несколько простых веществ называется аллотропией. Свойства аллотропных видоизменений элемента зависят от того, как и в каком количестве связываются между собой атомы в данном веществе (кислород O2, озон О3) и как они расположены в пространстве (алмаз и графит). Явление аллотропии широко распространено у неметаллов. В дальнейшем вы узнаете, что все элементы VIA-группы образуют несколько аллотропных форм.
Химические свойства и получение неметалловЗадание. Приведите примеры химических реакций неметаллов. Почему они являются окислительно-восстановительными? В процессе изучения химии вы уже познакомились со многими химическими реакциями неметаллов, в которых проявляются их химические свойства.
Убедимся в этом, рассмотрев, какие функции выполняют в окислительно-восстановительных реакциях неметаллы, с какими веществами они взаимодействуют. 1. Взаимодействие неметаллов с металлами. Вы уже знаете, что многие металлы горят в кислороде и хлоре. Задание. Опишите реакции кислорода, серы, хлора и других неметаллов с металлами. Составьте уравнения этих реакций методом электронного баланса (см. учебник химии для 8 класса). Назовите продукты этих реакций. Например:
|
|
|



 Какие вещества называются простыми, а какие сложными?
Какие вещества называются простыми, а какие сложными?
 Иод — твердое темно-серое кристаллическое вещество со слабым металлическим блеском. При нагревании легко возгоняется, образуя фиолетовые пары. При быстром повышении температуры он плавится [tпл = 114°С)икипит (tкип = 184°С).
Иод — твердое темно-серое кристаллическое вещество со слабым металлическим блеском. При нагревании легко возгоняется, образуя фиолетовые пары. При быстром повышении температуры он плавится [tпл = 114°С)икипит (tкип = 184°С).