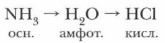|
|
|
|
|
Глава 3. Общая характеристика неметаллов § 14. Водородные и кислородные соединения неметаллов
Приведенные в нижней части периодической системы Д.И. Менделеева общие формулы высших кислородных и летучих водородных соединений элементов разных групп отражают типичные для этих групп элементов формы их соединений. Понятие «форма соединений» ввел в химию Д.И. Менделеев. Общие формулы отражают состав соединений, типичный для целой группы или подгруппы элементов. Задание. Опираясь на общие формулы водородных и кислородных соединений элементов 3-го периода, отметьте закономерные изменения состава и свойств этих соединений, а также изменения характера элементов. Элементы-неметаллы, в отличие от металлов, имеют газообразные водородные соединения. Их состав зависит от степени окисления неметалла При рассмотрении свойств летучих водородных соединений неметаллов в соответствии с их положением в периодах периодической системы можно наблюдать некоторые общие закономерности в изменении их свойств (полярность, растворимость, характер водородных и кислородных соединений). Вы уже знакомы с хорошей растворимостью хлороводорода в воде.
Рассмотрим сущность этого процесса: молекулы хлороводорода полярны, хорошо растворимы в воде и диссоциируют в ней по уравнению:
Н2O + НСl = Н3O+ + Сl-
При взаимодействии с водой каждая молекула хлороводорода отдает молекуле воды протон (катион водорода), который присоединяется к ней по донорно-акцепторному механизму, образуя ион гидроксония Н3O+. Именно от этого иона зависят кислотные свойства раствора хлороводорода (см. § 5).
В периодах слева направо усиливается кислотный характер водородных соединений неметаллов:
В А-группах полярность молекул, растворимость и основный характер водородных соединений неметаллов в воде, наоборот, уменьшаются при переходе сверху вниз: NH3 → РН3 → AsH3 По отношению к воде летучие водородные соединения неметаллов можно разделить на три группы: ВН3 + ЗН2О = Н3ВО3 + ЗН2 Газообразные водородные соединения, присущие p-элементам главных подгрупп, подчеркивают их неметаллический характер.
|
|
|



 Приведите примеры формул высших кислородных и летучих водородных соединений элементов 3-го периода. Для атомов каких элементов характерны такие водородные соединения?
Приведите примеры формул высших кислородных и летучих водородных соединений элементов 3-го периода. Для атомов каких элементов характерны такие водородные соединения?
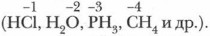
 Так, полярность молекул газообразных водородных соединений у элементов 3-го периода возрастает с увеличением ОЭО атомов при переходе от IV группы к VII, т. е. при уменьшении отрицательной степени окисления центрального атома:
Так, полярность молекул газообразных водородных соединений у элементов 3-го периода возрастает с увеличением ОЭО атомов при переходе от IV группы к VII, т. е. при уменьшении отрицательной степени окисления центрального атома:
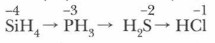
 Опыт. Еще раз обратимся к хорошо известному вам опыту по растворению хлороводорода в воде (см. учебник химии для 8 класса). Напомним, что в 1 л воды растворяется около 400 л хлороводорода. Вода с силой врывается в разреженное пространство, образовавшееся в сосуде, и бьет фонтаном, заполняя склянку. Добавленный в водный раствор лакмус краснеет, что доказывает образование кислоты.
Опыт. Еще раз обратимся к хорошо известному вам опыту по растворению хлороводорода в воде (см. учебник химии для 8 класса). Напомним, что в 1 л воды растворяется около 400 л хлороводорода. Вода с силой врывается в разреженное пространство, образовавшееся в сосуде, и бьет фонтаном, заполняя склянку. Добавленный в водный раствор лакмус краснеет, что доказывает образование кислоты.