|
|
|
|
|
Глава 5. Подгруппа азота и ее типичные представители Азотная кислота и ее солиПример взаимодействия:
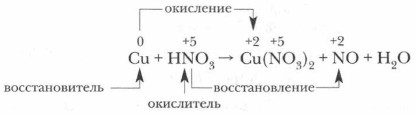
1. Опираясь на таблицу взаимодействия металлов с азотной кислотой (с. 125), определите преимущественный продукт восстановления HNO3 и обозначьте степень окисления отдельных элементов в составе реагентов.
2. Определите и обозначьте степени окисления атомов отдельных элементов в составе реагентов и продуктов реакции, указав окислитель и восстановитель, процессы окисления и восстановления.
3. Составьте схему электронного баланса и определите коэффициенты для окислителя и восстановителя. Выявите соотношение молекул кислоты и атомов металла, участвующих в окислительно-восстановительном процессе.
4. Определите число молекул кислоты, нужное для солеобразования, учитывая, что все вступившие в реакцию атомы металла (в виде ионов) войдут в состав соли — нитрата этого металла.
5. Завершите расстановку коэффициентов, проверив правильность уравнения реакции.
Соли азотной кислоты
Соли азотной кислоты — нитраты. Нитраты щелочных металлов, кальция и аммония имеют еще название селитры (например, аммиачная селитра — NH4NO3, калийная селитра — KNO3 и др.). Нитраты получаются при взаимодействии азотной кислоты с металлами, оксидами металлов, основаниями, аммиаком, а также с некоторыми солями. Задание. Приведите конкретные примеры получения нитратов и запишите уравнения возможных реакций. Физические и химические свойства нитратов. Нитраты — твердые кристаллические вещества, хорошо растворимые в воде (см. таблицу растворимости). 1. Нитраты как вещества с ионной кристаллической решеткой — сильные электролиты, полностью диссоциированные в воде, например:
В водных растворах они проявляют общие свойства солей: Cu(NO3)2 + 2КОН = Cu(OH)2↓ + 2KNO3
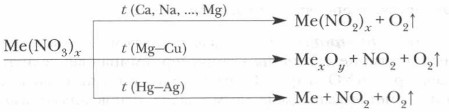
Задание. Запишите полные и сокращенные ионные уравнения реакций отражающих свойства нитратов как электролитов. 2. Нитраты, подобно азотной кислоте, будучи ее производными, проявляют ряд специфических свойств как окислители. При нагревании твердые нитраты разлагаются с выделением кислорода.
В зависимости от характера металлов, входящих в состав нитратов, реакции их разложения протекают по-разному. Распределим соли в соответствии с положением в ряду активности входящих в их состав металлов и обозначим продукты реакции.
Качественная реакция на нитрат-ион Качественная реакция на твердые нитраты. Щепотку соли бросают в огонь горелки. Если эта соль — нитрат, то происходит яркая вспышка вследствие ее разложения и выделения кислорода.
Применение азотной кислоты и ее солей. Азотная кислота является одним из крупнотоннажных и важных продуктов химической промышленности. Она широко применяется для производства удобрений, бездымного пороха, взрывчатых веществ (нитроглицерина, динамита и др.), лекарств, красителей, пластмасс. Нитраты также находят широкое применение. Селитра в большом количестве используется для получения некоторых оксидов металлов. Аммонийная селитра — хорошее удобрение. Кроме этого, из нее изготавливают взрывчатые смеси — аммоналы, применяемые при взрывных работах. На легкости выделения нитратами кислорода основано их применение в пиротехнике (в том числе в фейерверках). Основные понятия Строение молекулы азотной кислоты • Свойства HNO3 • Особенности взаимодействия HNO3 с металлами • Правила обращения с азотной кислотой • Нитраты • Селитра • Свойства нитратов • Применение азотной кислоты и нитратов Вопросы и задания
|
|
|



 Алгоритм составления уравнений реакций металлов с азотной кислотой.
Алгоритм составления уравнений реакций металлов с азотной кислотой.
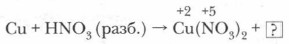
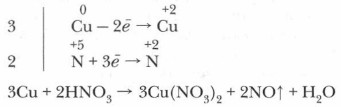
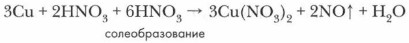
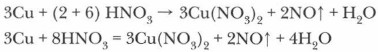
 Как называются соли азотной кислоты? Обратитесь к таблице растворимости и сделайте заключение об их отношении к воде.
Как называются соли азотной кислоты? Обратитесь к таблице растворимости и сделайте заключение об их отношении к воде.
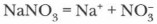

 Демонстрационный опыт. Сгорание угля в расплавленной селитре. Закрепим в штативе пробирку, на 1/5 заполненную кристаллической натриевой селитрой. Нагреем пробирку до расплавления селитры. В расплавленную селитру бросим последовательно мелкие кусочки угля. Они сгорают со вспышкой (рис. 40):
Демонстрационный опыт. Сгорание угля в расплавленной селитре. Закрепим в штативе пробирку, на 1/5 заполненную кристаллической натриевой селитрой. Нагреем пробирку до расплавления селитры. В расплавленную селитру бросим последовательно мелкие кусочки угля. Они сгорают со вспышкой (рис. 40):
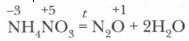
 (т. е. на растворы азотной кислоты и ее солей). В пробирку с исследуемым веществом добавляют медные стружки, приливают концентрированную серную кислоту и нагревают. Выделение бурого газа оксида азота (IV) NO,, свидетельствует о наличии нитрат-иона.
(т. е. на растворы азотной кислоты и ее солей). В пробирку с исследуемым веществом добавляют медные стружки, приливают концентрированную серную кислоту и нагревают. Выделение бурого газа оксида азота (IV) NO,, свидетельствует о наличии нитрат-иона.
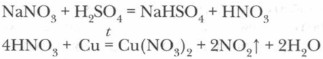
 1. Охарактеризуйте физические свойства азотной кислоты и правила безопасного обращения с ней.
1. Охарактеризуйте физические свойства азотной кислоты и правила безопасного обращения с ней.
 3. Какие отличительные признаки присущи нитратам как производным азотной кислоты? Ответ подтвердите уравнениями реакций.
3. Какие отличительные признаки присущи нитратам как производным азотной кислоты? Ответ подтвердите уравнениями реакций.
 5. Напишите уравнения реакций следующих превращений:
5. Напишите уравнения реакций следующих превращений:
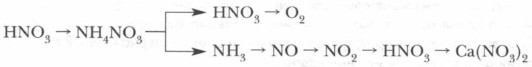
 9. Придумайте кроссворд, ребус или загадки по теме.
9. Придумайте кроссворд, ребус или загадки по теме.