|
|
|
|
|
Глава 6. Подгруппа углерода § 34. Кремний и его свойства. Соединения кремния
Кремний — важнейший элемент земной коры, по распространенности он занимает второе место после кислорода (примерно 27,6%). Кремний имеет три изотопа: Кремний существует в двух аллотропных модификациях: аморфный и кристаллический. Различие в строении обусловливает и различие в физических свойствах этих модификаций. Аморфный кремний — бурый порошок, не имеет определенной температуры плавления. Кристаллический кремний по внешнему виду похож на металл, темно-серого цвета с металлическим блеском, тугоплавок (температура плавления 1400°С), но к металлам его не относят, так как он хрупок, слабо проводит электрический ток и проявляет химические свойства неметаллов. Структура кристаллического кремния аналогична структуре алмаза. В его кристалле каждый атом соединен с четырьмя другими ковалентными связями. Причем ковалентная связь между атомами кремния значительно слабее, чем между атомами углерода в алмазе. Даже при обычных условиях часть связей разрушается и появляются свободные электроны, которые обусловливают небольшую электрическую проводимость. При нагревании и освещении число разрушающихся связей возрастает, следовательно, появляется больше свободных электронов, увеличивается электрическая проводимость. Кристаллический кремний — полупроводник. Полупроводниками называют вещества, электрическая проводимость которых занимает промежуточное место между проводимостью металлов и диэлектриков. Более подробно вы будете изучать это явление на уроках физики в старших классах. На этом свойстве основано применение кремния при изготовлении выпрямителей переменного тока и солнечных батарей, преобразующих тепловую энергию солнца в электрическую. Такие батареи устанавливаются на искусственных спутниках Земли, используются и в наземных условиях. Разное строение кремния (аморфного и кристаллического) обусловливает и разную химическую активность аллотропных модификаций. При обычных условиях кристаллический кремний инертен, а аморфный сгорает во фторе:
При нагревании кремний взаимодействует со многими неметаллами (кислородом, хлором, азотом, углеродом, серой), и при этом выделяется большое количество теплоты. Кремний соединяется с металлами. Эти соединения называются силицидами. Задание. Задание 1. Напишите соответствующие уравнения реакций и укажите функции кремния в окислительно-восстановительных реакциях. Задание 2. Напишите уравнения химических реакций кремния с магнием, алюминием. Укажите окислитель, восстановитель. Сделайте вывод, какую степень окисления проявляет кремний. Кислоты (кроме плавиковой HF) на кремний не действуют, однако при сплавлении гидроксидов щелочных металлов с кремнием образуется соль кремниевой кислоты — силикат и водород:
При высокой температуре кремний восстанавливает многие металлы из их оксидов:
В чистом виде кремний в природе не встречается. Впервые кремний был получен в 1822 г. шведским ученым И. Берцелиусом путем восстановления фторида кремния SiF4 металлическим калием при нагревании до 400 °С. Еще легче его получить восстановлением SiO2 металлическим магнием:
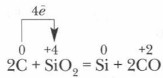
В промышленности кремний получают обычно при нагревании смеси песка и кокса:
Восстановленный кремний частично реагирует с избытком углерода, и образуется карборунд Задание. Как правильно называть SiC — карбидом кремния или силицидом углерода? Дайте обоснованный ответ. Соединения кремния
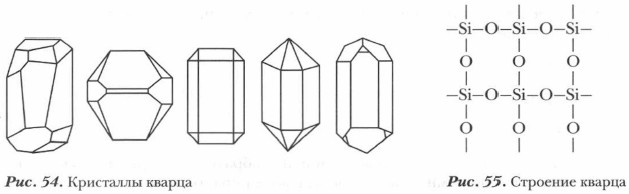
В природе кремний находится преимущественно в виде кремнезема (песка) SiO2 и силикатов. Чистые кристаллы оксида кремния (IV) образуют несколько полиморфных модификаций, одна из которых кварц, встречающийся в виде горного хрусталя. Красиво окрашенные кристаллы кварца (аметист, дымчатый топаз, черный морион, сердолик, агат, опал, яшма и др.) являются полудрагоценными камнями. Оксид кремния (IV) SiO2 — твердое тугоплавкое вещество (температура плавления 1713°С), нерастворимое в воде (рис. 54). Он обладает атомной кристаллической решеткой (рис. 55): здесь нет молекул, около каждого атома кремния располагаются четыре атома кислорода — образуется своеобразный пространственный каркас. Кусок кварца представляет собой как бы одну гигантскую молекулу. Кварц — неорганический полимер, его формула (SiO2)n.
|
|
|



 Охарактеризуйте положение кремния в периодической системе химических элементов.
Охарактеризуйте положение кремния в периодической системе химических элементов.
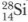 i (92,27%);
i (92,27%); 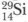 (4,68%);
(4,68%);  (3,05%).
(3,05%).

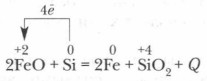
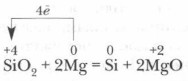
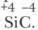 Карборунд имеет алмазоподобную кристаллическую решетку, ковалентные связи в ней очень прочные, поэтому по твердости он близок к алмазу, используется для изготовления точильных камней и шлифовальных кругов.
Карборунд имеет алмазоподобную кристаллическую решетку, ковалентные связи в ней очень прочные, поэтому по твердости он близок к алмазу, используется для изготовления точильных камней и шлифовальных кругов.