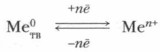|
|
|
|
|
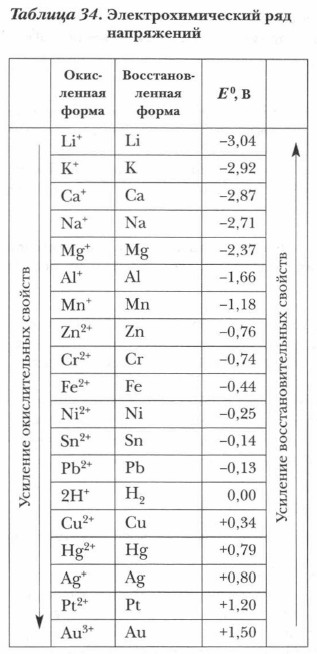
Дополнительный материал к § 48 Электрохимический ряд напряжений металлов и его использование при выполнении самостоятельных работВажной количественной характеристикой восстановительных свойств металла и окислительных свойств его иона является электродный потенциал Е0. Он характеризует также способность металла переходить в гидратированный ион. Если расположить металлы в порядке убывания их восстановительной способности, характеризуемой их электродными потенциалами Е0, получится электрохимический ряд напряжений (табл. 34), прототипом которого является ряд активности.
Электрохимический ряд напряжений представляет собой сложную обобщенную количественную электрохимическую характеристику металлов и их ионов, связанных между собой в систему Ме/Меn+. Этот ряд выражает в обобщенной форме следующие закономерности: а) последовательное уменьшение восстановительных свойств металлов по отношению к растворам кислот и солей и повышение окислительных свойств их ионов в растворах; б) закономерную взаимосвязь (сопряжение) металлов и их ионов в окислительно-восстановительных реакциях (металл — восстановитель, его ион — окислитель):
в) уменьшение способности металлов переходить в водных растворах электролитов в гидратированные ионы. Электрохимический ряд напряжения металлов (см. табл. 34) служит важной ориентировочной основой для определения возможностей протекания окислительно-восстановительных реакций металлов, их направлений, для составления уравнений этих реакций. Поэтому важно научиться правильно использовать его в своей учебной работе. Для применения ряда напряжений следует знать ряд положений по его использованию и границы применения этого ряда. Электрохимический ряд напряжений металлов в качественном и количественном плане отражает последовательное изменение электрохимических свойств металлов и сопряженных с ними ионов. Он используется для определения принципиальной возможности протекания окислительно-восстановительных реакций металлов (с растворами кислот и солей). При этом важно учитывать следующие положения:
|
|
|