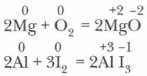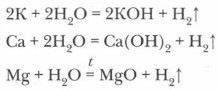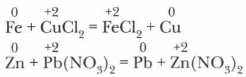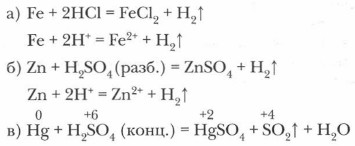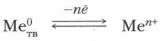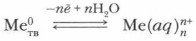|
|
|
|
|
Глава 8. Общие свойства металлов § 48. Химические свойства металлов
Вы наблюдали многие химические свойства металлов и записывали уравнения их реакций. Вы хорошо помните яркое горение ленты магния, стального пера в кислороде, взаимодействие порошков серы и железа, впечатляющее взаимодействие алюминия с иодом, горение натрия в хлоре и многое другое. Напишем уравнения этих реакций и укажем условия, при которых перечисленные реакции протекают. 1. Реакции металлов с простыми веществами-неметаллами — это окислительно-восстановительные реакции:
2. В реакцию с водой вступают щелочные, щелочноземельные металлы и алюминий, очищенный от оксидной пленки;
3. В реакциях металлов с растворами солей более активный металл вытесняет менее активный:
4. Металлы взаимодействуют с кислотами:
Чтобы самостоятельно записывать уравнения реакций металлов с кислотами и солями, важно правильно определить продукт реакции. Для этого можно использовать разные ориентировочные основы (ряд активности металлов, таблицу растворимости, схемы взаимодействия металлов с кислотами и солями и др.). Анализ взаимодействия металлов с разными веществами позволяет сделать следующие обобщающие выводы.
Сущность химических реакций металлов (окислительно-восстановительных реакций) отражают: а) обобщенные уравнения с газообразными и твердыми реагентами:
б) обобщенные уравнения с водными растворами солей и кислот:
|
|
|



 Какие свойства называются химическими? Что вы понимаете под реакционной способностью веществ?
Какие свойства называются химическими? Что вы понимаете под реакционной способностью веществ?