|
|
|
|
|
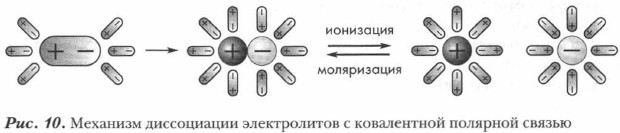
Глава 2. Растворы. Теория электролитической диссоциации Механизм электролитической диссоциации веществ с ковалентной полярной связью
Сравните кислоты, соли и щелочи по особенностям их строения. В узлах кристаллических решеток ионных соединений (солей и щелочей) находятся ионы. В соединениях с ковалентной полярной связью, к которым относятся кислоты, ионов нет. Следовательно, механизм электролитической диссоциации кислот отличается от рассмотренного выше механизма растворения соли NaCl в воде (рис. 7, § 4). В процессе электролитической диссоциации (ЭД) ковалентных полярных соединений под влиянием молекул воды происходят глубокие изменения. Рассмотрите рисунок 10. Примером ковалентного полярного соединения является хлороводород НС1. Молекула хлороводорода — диполь вследствие значительной полярности связи Н—Cl. Молекулы воды, также являющиеся диполями, притягиваются к ее концам и в результате диполь-дипольно- го взаимодействия усиливают поляризацию молекулы электролита, от которой отщепляется катион водорода (протон). Напомним, что силы взаимодействия между заряженными частицами в воде уменьшаются в 81 раз. В этом случае процесс образования ионов из молекул электролита является отщеплением протона от полярной молекулы хлороводорода с последующей его гидратацией (гидратация хлорид-иона здесь не учитывается), ведущей к образованию иона гидроксония (Н3О+):
Атом кислорода в составе молекулы воды имеет неподеленные электронные пары, за счет одной из которых и образуется ковалентная связь между атомом кислорода и протоном. При этом атом кислорода выступает в роли донора, предоставляющего пару электронов в «общее пользование», а протон выступает в роли акцептора, принимающего электроны. Такой механизм образования ковалентной связи называется доиорно-акцепторным. Уравнение реакции диссоциации хлороводорода выглядит следующим образом:
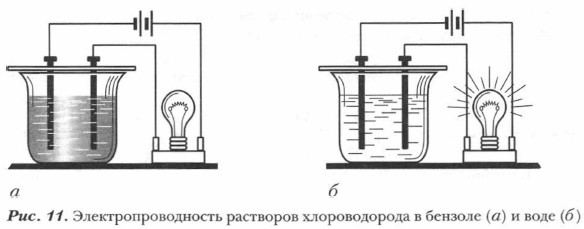
Подтвердить роль воды в процессе электролитической диссоциации можно с помощью опыта, схема которого представлена на рисунке 11. Лампочка прибора загорается только при погружении электродов в раствор электролита, диссоциировавшего на ионы.
В молекулах кислородсодержащих кислот наиболее полярные связи образованы атомами водорода и кислорода. Поэтому при диссоциации этих кислот обычно отщепляется протон. Например: Диссоциация многоосновных кислот протекает обратимо и ступенчато: сначала отщепляется один протон, затем второй, третий и т. д.:
Обычно уравнения электролитической диссоциации кислот записывают упрощенно, без учета образования иона гидроксония:
Диссоциация многоосновных кислот протекает главным образом по первой ступени, в меньшей мере — по второй и лишь в незначительной степени — по третьей. Основные понятия Механизм диссоциации кислот • Ступенчатая диссоциация многоосновных кислот Вопросы и задания
|
|
|



 Неорганические вещества каких классов относятся к электролитам?
Неорганические вещества каких классов относятся к электролитам?
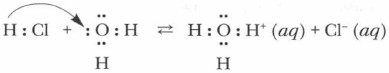
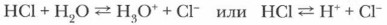
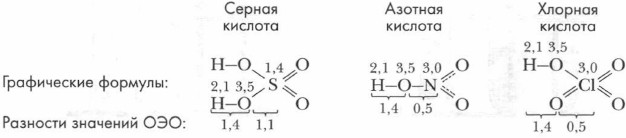
 При диссоциации более сложных молекул разрушению в первую очередь подвергается наиболее полярная связь. Определить ее можно, сравнивая значения относительных электроотрицательностей (ОЭО) атомов элементов, образующих молекулу. Рассмотрим конкретные примеры. Составим графические формулы кислот, расставим значения ОЭО атомов элементов, определим разность значений ОЭО:
При диссоциации более сложных молекул разрушению в первую очередь подвергается наиболее полярная связь. Определить ее можно, сравнивая значения относительных электроотрицательностей (ОЭО) атомов элементов, образующих молекулу. Рассмотрим конкретные примеры. Составим графические формулы кислот, расставим значения ОЭО атомов элементов, определим разность значений ОЭО:
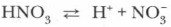
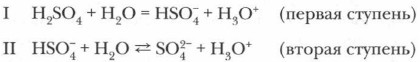
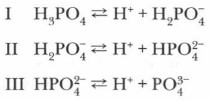
 1. Объясните роль воды в процессе электролитической диссоциации кислот.
1. Объясните роль воды в процессе электролитической диссоциации кислот.
 2. Почему кислоты, в отличие от ионных электролитов, диссоциируют по стадиям? Составьте уравнения электролитической диссоциации фосфорной, азотной, сероводородной, сернистой кислот.
2. Почему кислоты, в отличие от ионных электролитов, диссоциируют по стадиям? Составьте уравнения электролитической диссоциации фосфорной, азотной, сероводородной, сернистой кислот.